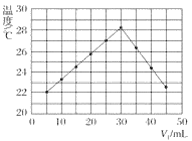
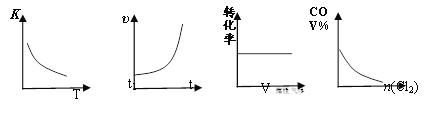
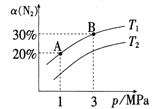
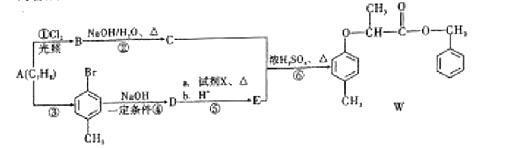
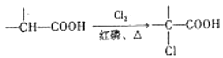
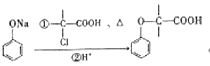
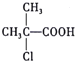
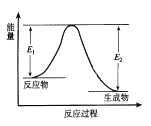
题目内容
【题目】靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+ 6NiO(OH)![]() LaNi5+ 6Ni(OH)2。下列说法正确的是
LaNi5+ 6Ni(OH)2。下列说法正确的是
A.放电时储氢合金作正极B.充电时储氢合金作阳极
C.充电时阳极周围c(OH-)增大D.放电时负极反应:LaNi5H6+ 6OH-- 6e-= LaNi5+ 6H2O
【答案】D
【解析】
此电池放电时的反应为LaNi5H6+ 6NiO(OH)![]() LaNi5+ 6Ni(OH)2,正极反应为6NiOOH+6H2O+6e-=6Ni(OH)2+6OH-,负极反应为LaNi5H6+ 6OH-- 6e-=LaNi5+6H2O。由此可见储氢合金失电子,作原电池的负极。充电是放电的逆反应,据此解答。
LaNi5+ 6Ni(OH)2,正极反应为6NiOOH+6H2O+6e-=6Ni(OH)2+6OH-,负极反应为LaNi5H6+ 6OH-- 6e-=LaNi5+6H2O。由此可见储氢合金失电子,作原电池的负极。充电是放电的逆反应,据此解答。
A、放电时是原电池,依据总反应化学方程式可知,储氢合金做电池的负极,故A错误;
B、充电时,储氢合金得电子发生还原反应,作阴极,故B错误;
C、充电时为电解池,阳极电极反应为:6Ni(OH)2+6OH--6e-=6NiOOH+6H2O,氢氧根离子浓度减小,故C错误;
D、放电时,负极失电子发生氧化反应,电极反应为:LaNi5H6+ 6OH-- 6e-=LaNi5+6H2O,故D正确;
故选:D。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗干净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20. 00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_____________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是__________________________________________。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.61 | 20.60 | |
滴定中误差较大的是第_______次实验,造成这种误差的可能原因是_______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为________mol/L。
(5)如果准确移取20. 00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?______________(填“是”或“否”)。