题目内容
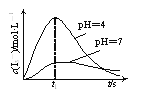
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
【答案】B
【解析】
A、由图,将图中左侧的直线延长,可知该实验开始温度是21 ℃,A错误;
B、盐酸与氢氧化钠溶液的中和反应是放热反应,化学能转化为热能;B正确;
C、恰好反应时参加反应的盐酸溶液的体积是30 mL,由V1+V2=50 mL可知,消耗的氢氧化钠溶液的质量为20 mL, 氢氧化钠溶液的物质的量浓度=0.03 L×1.0 mol·L-1÷0.02 L=1.5mol·L-1,C错误;
D、有水生成的反应不一定是放热反应,如氢氧化钡晶体与氯化铵反应有水生成,该反应是吸热反应,D错误;
答案选B。

 挑战100单元检测试卷系列答案
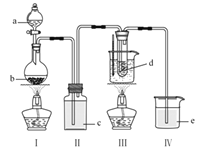
挑战100单元检测试卷系列答案【题目】氧化锌为白色粉末,可用于皮肤病的治疗。提纯工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
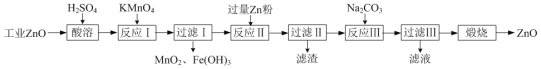
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 8.2 | 8.9 |
(1)写出两种“酸溶”时可以加快反应速率的方法__________、__________。
(2)“反应Ⅰ”溶液的pH≈5,“反应Ⅰ”目的是除去Fe(Ⅱ)、Mn(Ⅱ),写出“反应Ⅰ”中除去Mn(Ⅱ)的离子方程式:__________。
(3)“过滤Ⅱ”所得滤渣的成分为__________。
(4)向“过滤Ⅱ”所得滤液中滴加Na2CO3溶液,所得沉淀为ZnCO3,若反过来滴加,则沉淀中会含有Zn(OH)2。反过来滴加生成Zn(OH)2的原因是__________。
⑸“过滤Ⅲ”所得沉淀需进行洗涤,检查沉淀已经洗涤干净的方法是__________。