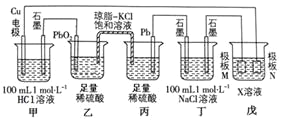
题目内容
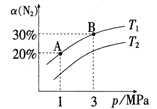
【题目】已知反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g) ΔH=-92.3kJ/moL,N2的平衡转化率a(N2)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1molN2与3molH2置于1L密闭容器中充分反应,放出的热量为92.3kJ
B.T1<T2
C.平衡状态由A变到B时,平衡常数K(A)<K(B)
D.升高温度,平衡向逆反应方向移动,逆反应速率增大,正反应速率减小
【答案】B
【解析】
A.可逆反应反应物不能完全转化,结合热化学方程式的含义解答;
B.升高温度,N2的平衡转化率a(N2)降低,据此回答;
C.平衡常数只受温度影响,与压强无关;
D.升高温度正、逆反应速率都增大,逆反应速率比正反应速率增大更多,平衡向逆反应方向移动。
A.热化学方程式N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.3kJ/moL表示1mol N2(g)与3mol H2(g)反应生成2mo NH3(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,A错误;
2NH3(g) ΔH=-92.3kJ/moL表示1mol N2(g)与3mol H2(g)反应生成2mo NH3(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,A错误;
B.该反应的正反应为放热反应,升高温度,化学平衡逆向移动,N2的平衡转化率a(N2)降低,则T1<T2,B正确;
C.平衡常数只受温度影响,与压强无关,增大压强,化学平衡常数不变,故平衡常数K(A)=K(B),C错误;
D.升高温度,正、逆反应速率都增大,逆反应速率比正反应速率增大更多,所以化学平衡向逆反应方向移动,D错误;
故合理选项是B。

【题目】已知:![]()
![]() 时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
浓度 时间 | NO |
|
|
0 |
| 0 | 0 |
10 |
|
|
|
20 |
|
|
|
30 |
|
|
|
35 |
|
|
|
![]() 以v(NO)表示的平均反应速率为 ______ .
以v(NO)表示的平均反应速率为 ______ .
![]() 根据表中数据,计算平衡时的NO转化率为 ______ .
根据表中数据,计算平衡时的NO转化率为 ______ .
![]() 根据表中数据,计算
根据表中数据,计算![]() 时该反应的平衡常数为 ______ .
时该反应的平衡常数为 ______ .
![]() 改变的实验条件是 ______ .
改变的实验条件是 ______ .