题目内容
【题目】Ⅰ(1)标准状况下,1.7 g NH3与_______L H2S气体含有的氢原子数相同。
(2)2 mol的CO2与3 mol的SO3的原子数之比是__________。
(3)常温常压下22.4升CO2中分子个数___64克SO2的分子个数(填“>、<或=”)
(4)标准状况下,33.6L的NH3所含电子的物质的量约为______mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为__________mol/L
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为________。
(6)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2molL﹣1、0.25molL﹣1、0.4molL﹣1,则c(SO42﹣)=__________.
(7)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为_________________,NH3的体积分数为______________.
(9)VmLAl2(SO4)3溶液中含Al3+ ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是_____________mol/L。
Ⅱ.请按照要求完成下列方程式。
(1)写出泡沫灭火器反应原理的离子方程式:_______________________________________。
(2)铁与水蒸气高温下反应的化学方程式:____________________________________________。
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应的离子方程式:___________________________________。
(4)亚硝酸盐是毒性较强的物质,其具有较强的还原性,将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液(橙色)中,溶液由橙色变为绿色(Cr3+),试写出反应的离子方程式:__________________________。
(5)将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式:_____________________。
【答案】3.36L 1∶2 < 15 1.5 24.5L/mol 0.15mol/L 6:3:2 16.8g/mol 80% 125a/9V Al3++3HCO3-===Al(OH)3↓+3CO2↑ 3Fe+4H2O(g)![]() Fe3O4+4H2 CN-+S2O32-===SCN-+SO32- Cr2O72-+3NO2-+8H+===2Cr3++3NO3-+4H2O Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O
Fe3O4+4H2 CN-+S2O32-===SCN-+SO32- Cr2O72-+3NO2-+8H+===2Cr3++3NO3-+4H2O Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O
【解析】
Ⅰ由公式n=![]() =
=![]() =
=![]() cV进行运算,结合电荷守恒、原子守恒等计算技巧可得;
cV进行运算,结合电荷守恒、原子守恒等计算技巧可得;
Ⅱ. (1)碳酸氢钠和硫酸铝水解相互促进生成CO2;
(2)铁与水蒸气在高温下反应生成四氧化三铁和氢气;
(3)CN-与S2O32-反应生成SCN-和SO32-;
(4)根据得失电子守恒、原子守恒、电荷守恒可写;
(5)Ba(OH)2溶液与NaHSO4溶液的反应后呈中性,说明生成物是硫酸钡、硫酸钠和水。
Ⅰ(1)n(NH3)=![]() =0.1mol,n(H)=0.3mol,则含有的氢原子数相同的H2S物质的量为0.15mol,标准状况下,0.15mol H2S气体占有的体积是3.36L;
=0.1mol,n(H)=0.3mol,则含有的氢原子数相同的H2S物质的量为0.15mol,标准状况下,0.15mol H2S气体占有的体积是3.36L;
(2)2 mol CO2的原子数为6NA,3 mol SO3的原子数为12NA,则2 mol CO2与3 molSO3的原子数之比是1∶2;
(3)常温常压下,气体摩尔体积大于22.4L/mol,22.4L CO2中分子个数小于NA,
64克SO2的分子个数为NA,常温常压下22.4升CO2中分子个数<64克SO2的分子个数;
(4)标准状况下,n(NH3)=![]() =1.5mol,所含电子的物质的量约为1.5mol
=1.5mol,所含电子的物质的量约为1.5mol ![]() 15mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为
15mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为![]() =1.5mol/L;
=1.5mol/L;
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为![]() =24.5L/mol;
=24.5L/mol;
(6)由电荷守恒:c(Na+)+ 2c(Mg2+)= c(Cl﹣)+ 2c(SO42﹣)代入数值得0.2molL﹣1+ 2![]() 0.25molL﹣1= 0.4molL﹣1+ 2c(SO42﹣),则c(SO42﹣)=0.15mol/L;
0.25molL﹣1= 0.4molL﹣1+ 2c(SO42﹣),则c(SO42﹣)=0.15mol/L;
(7)分别与足量的AgNO3溶液反应,生成沉淀的质量相等,则n(Cl﹣)相等。设AgCl为1mol,根据氯离子守恒,则n(NaCl)=1mol、n(CaCl2)=0.5mol,n(AlCl![]() mol,故NaCl、CaCl2、AlCl3的物质的量之比=1mol:0.5mol:
mol,故NaCl、CaCl2、AlCl3的物质的量之比=1mol:0.5mol:![]() mol=6:3:2,等体积的NaCl、CaCl2、AlCl3三种溶液,三种溶液中所含溶质的物质的量浓度之比= NaCl、CaCl2、AlCl3的物质的量之比=6:3:2;
mol=6:3:2,等体积的NaCl、CaCl2、AlCl3三种溶液,三种溶液中所含溶质的物质的量浓度之比= NaCl、CaCl2、AlCl3的物质的量之比=6:3:2;
(8)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量=0.75g/L![]() L/mol=16.8 g/mol。设NH3的体积分数为x,则甲烷体积分数为(1-x),则17x+16(1-x)=16.8,解得x=0.8,即NH3的体积分数为80%;
L/mol=16.8 g/mol。设NH3的体积分数为x,则甲烷体积分数为(1-x),则17x+16(1-x)=16.8,解得x=0.8,即NH3的体积分数为80%;
(9)含Al3+ ag,n(Al3+)=![]() mol,n(SO42-)=
mol,n(SO42-)=![]() mol。VmLAl2(SO4)3溶液中,取0.5VmL溶液,取出的n(SO42-)=
mol。VmLAl2(SO4)3溶液中,取0.5VmL溶液,取出的n(SO42-)=![]() mol,稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度=
mol,稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度=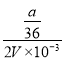 mol/L=125a/9V mol/L;
mol/L=125a/9V mol/L;
Ⅱ. (1)(1)碳酸氢钠和硫酸铝水解相互促进,生成CO2可灭火,泡沫灭火器反应原理的离子方程式为3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,该离子为SCN-;另一种与H+作用产生能使品红溶液褪色的刺激性气体,该气体为二氧化硫,生成的另一种离子为SO32-,该反应的离子反应方程式为:CN-+S2O32-=SCN-+SO32-;
(4)反应中Cr2O72-→Cr3+,Cr元素由+6价降低为+3价,共降低6价,NO2-→NO3-,N元素由平均化合价+3价升高为+5价,共升高2价,化合价最小公倍数为6,Cr2O72-的系数为1,NO2-的系数为3,再根据原子守恒、电荷守恒配平其它物质系数,配平后的方程式为Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O;
(5)Ba(OH)2溶液与NaHSO4溶液的反应后呈中性,说明生成物是硫酸钡、硫酸钠和水,离子反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案