题目内容
【题目】氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的电子排布式为____,碳、氮、氧元素的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)NH4Cl中阳离子的空间构型为______,与NH4+互为等电子体的一种非极性分子的化学式为________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为_______(配位键用→表示)。
(4)GaAs与GaN均为原子晶体,GaAs熔点为1238℃,GaN熔点约为1500°,GaAs熔点低于GaN的原因为_________。
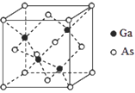
(5)GaAs的晶胞结构如图所示,其中As原子形成的空隙类型有正八面体形和正四面体形,该晶胞中Ga原子所处空隙类型为_______。已知GaAs的密度为ρ g/cm3,Ga和As的摩尔质量分别为 MGa g/mol和MAsg/mol,阿伏伽德罗常数的值为NA,则GaAs晶胞中Ga之间的最短距离为_______pm(写出表达式)。
【答案】1s22s22p3 C<O<N 正四面体 CH4  GaN中N原子半径小,Ga-N键长比Ga-As短,键能更大,熔点更高 正四面体形
GaN中N原子半径小,Ga-N键长比Ga-As短,键能更大,熔点更高 正四面体形 ![]()
【解析】
(1)N处于第二周期VA族;同一周期主族元素随原子序数增大,第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻元素;
(2)NH4Cl中氮原子形成4个N-H键,没有孤电子对,杂化轨道数目为4;与NH4+互为等电子体的一种非极性分子可以用碳原子替换N原子与1个单位正电荷;
(3)氨气分子中N原子提供孤电子对,铜离子提供空轨道,NH3与Cu2+形成[Cu(NH3)4]2+配离子;
(4)从物质的晶体类型、原子半径大小分析物质熔沸点的高低;
(5)Ga原子周围与之距离最近写相等的As原子有4个,形成正四面体结构,Ga处于正四面体的中心。四面体棱长即为Ga之间的最短距离,由几何知识可知二者距离等于晶胞体对角线长度的![]() 倍,均摊法计算晶胞中Ga、As原子数目,计算晶胞质量,结合晶胞质量=晶胞体积×晶体密度计算晶胞棱长。
倍,均摊法计算晶胞中Ga、As原子数目,计算晶胞质量,结合晶胞质量=晶胞体积×晶体密度计算晶胞棱长。
(1)N是7号元素,原子核外电子排布2、5,处于第二周期VA族,价电子排布式为:2s22p3;同一周期的主族元素,随原子序数增大,元素的第一电离能呈增大趋势,但N原子2p轨道为半充满稳定状态,第一电离能高于同周期相邻的O元素,故第一电离能:C<O<N;
(2)NH4Cl中氮原子形成了4个N-H键,没有孤电子对,杂化轨道数目为4,N原子杂化方式为:sp3,空间构型为正四面体形;与NH4+互为等电子体的一种非极性分子可以用碳原子替换N原子与1个单位正电荷,该非极性分子为:CH4;
(3)氨气分子中N原子上有一对孤电子对,N原子提供孤电子对,铜离子提供空轨道,NH3与Cu2+形成[Cu(NH3)4]2+配离子,配离子结构式为 ;
;
(4)GaAs与GaN均为原子晶体,原子间通过共价键结合,由于原子半径N<As,原子共价键的键长Ga-As>Ga-N,键长越长,共价键的结合的牢固程度就越强,断裂共价键使物质熔化、气化需要的能量就越高,即物质的熔沸点越高,所以GaAs熔点低于GaN;
(5)Ga原子周围与之距离最近写相等的As原子有4个,形成正四面体结构,Ga处于正四面体的中心。四面体棱长即为Ga之间的最短距离,由几何知识可知二者距离等于晶胞体对角线长度的![]() 倍,晶胞中Ga原子数目为4、As原子数目=8×
倍,晶胞中Ga原子数目为4、As原子数目=8×![]() +6×
+6×![]() =4,故晶胞质量=4×
=4,故晶胞质量=4×![]() g,设晶胞棱长为a pm,则:4×
g,设晶胞棱长为a pm,则:4×![]() g=ρgcm-3×(a×10-10cm)3,解得a=
g=ρgcm-3×(a×10-10cm)3,解得a=![]() ×1010,故GaAs晶胞中Ga之间的最短距离=
×1010,故GaAs晶胞中Ga之间的最短距离=![]() ×
×![]() ×1010pm。
×1010pm。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应![]() 正反应放热
正反应放热![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 | 700 | 700 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的平衡转化率α |
|
|
|
平衡常数K |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() ,
,![]() B.
B. ![]() ,
,![]()
C. ![]() ,
,![]() D.
D. ![]() ,
,![]()
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。
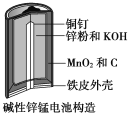
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为:Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH。
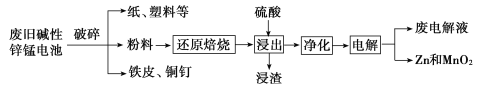
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如图所示:
回答下列问题:
(1)MnOOH中,Mn元素的化合价为_________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有_________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。常温下,已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol/L,根据下列数据计算,调节pH的合理范围是______至__________。(离子浓度小于1×10-5 mol/L即为沉淀完全)
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_________。本工艺中应循环利用的物质是_______(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,且生成一种黄绿色气体,“粉料”中的MnOOH与盐酸反应的化学方程式为__________。
