题目内容
【题目】下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分为次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH溶液处理NO2和HCl废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
【答案】C
【解析】
A.漂白粉的主要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2,A不正确;
B.2NH3+H2SO4===(NH4)2SO4,即碱性气体不能用酸性物质干燥,B不正确;
C.酸性气体均可用NaOH吸收,C正确;
D.Al3++3H2O![]() Al(OH)3+3H+,Al(OH)3胶体具有吸附性,能吸附水中的悬浮物,酸性和碱性的溶液均能与Al(OH)3反应,从而不能吸附水中的悬浮物,D不正确。
Al(OH)3+3H+,Al(OH)3胶体具有吸附性,能吸附水中的悬浮物,酸性和碱性的溶液均能与Al(OH)3反应,从而不能吸附水中的悬浮物,D不正确。
故选C。

【题目】某兴趣小组用粗CuO(仅含杂质FeO)制备氯化铜晶体(CuCl2·2H2O)并进一步测定纯度,具体流程如下:

相关信息如下:
①氯化铜从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
②金属离子形成氢氧化物沉淀的pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Cu2+ | 5.2 | 6.4 |
(1)步骤II加入稍过量的双氧水的目的是___。
(2)步骤III,需要用到下列所有的操作:
a.用盐酸溶解 b.调pH=3.0 c.调pH=7.0 d.洗涤 e.过滤。
请给出上述操作的正确顺序________(操作可重复使用)。
(3)步骤IV的装置图如图:
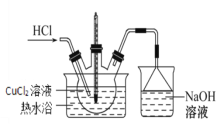
①持续通入HCl的作用是________。
②加热蒸发浓缩,当溶液体积减少到原来的![]() 时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
时,调整水浴温度控制在_______时析出晶体,抽滤,洗涤,干燥。
③关于上述操作的说法不合理的是________。
A.抽滤时,需用玻璃纤维替代滤纸
B.洗涤晶体时应先关闭水龙头,再加入洗涤剂
C.抽滤完毕时,断开水泵和吸滤瓶之间的橡胶管,再关闭水龙头
D.为得到纯净的CuCl2·2H2O晶体宜采用低温干燥
(4)用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.4000g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.1000mol·L-1Na2S2O3 标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(滴定反应为I2+2S2O32-=S4O62-+2I-)
①写出生成白色CuI沉淀的离子方程式________。
②该样品中CuCl2·2H2O的质量分数为________。