题目内容
【题目】某小组制取氯气并进行氯气的性质实验,其装置如图所示,回答下列问题:
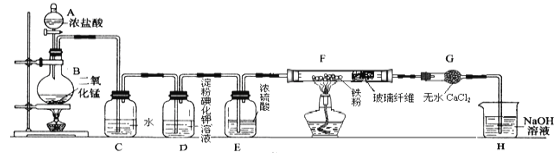
(1)仪器A的名称是 ______,实验中制备氯气的反应方程式为 ____________________。
(2)C中发生反应的化学方程式为 ______ .若将干燥的有色布条放入C中,观察到的现象是 ______,原因是 ___________________________。
(3)实验中观察到D溶液变蓝色,查资料得知淀粉碘化钾溶液是淀粉和碘化钾(KI)的混合溶液,写出D装置中发生反应的离子方程式______________________。
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解, 100℃左右时升华.双通管F中玻璃纤维(不参与反应)的作用是 ______ ;在F和H装置之间安装G装置的目的是____。
(5)H中NaOH溶液的作用是 _______________________________。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+H2O=HCl+HClO 有色布条褪色 氯气与水反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色 Cl2+2I-=I2+2Cl- 防止氯化铁堵塞后面的导管 防止H中的水蒸气进入F中,使五水三氯化铁潮解 吸收多余的氯气,防止空气污染
MnCl2+Cl2↑+2H2O Cl2+H2O=HCl+HClO 有色布条褪色 氯气与水反应生成了次氯酸,次氯酸具有强氧化性,从而使有色布条褪色 Cl2+2I-=I2+2Cl- 防止氯化铁堵塞后面的导管 防止H中的水蒸气进入F中,使五水三氯化铁潮解 吸收多余的氯气,防止空气污染
【解析】
(1)依据仪器形状说出其名称,实验室用加热二氧化锰与浓盐酸制取氯气据此解答;
(2)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,据此解答;
(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝;
(4)依据生成的固体氯化铁能堵塞导管,导致发生爆炸,氯化铁易吸水潮解的性质解答;
(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠反应,据此解答。
(1)依据仪器形状可知仪器A的名称是分液漏斗;实验室用加热二氧化锰与浓盐酸制取氯气,二者反应生成氯化锰、氯气和水,方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气与水反应生成盐酸和次氯酸,方程式为Cl2+H2O=HCl+HClO,次氯酸具有漂白性,从而使有色布条褪色,所以若将干燥的有色布条放入C中,观察到的现象是有色布条褪色;
(3)氯气氧化性强于碘单质,氯气与碘离子发生氧化还原反应生成碘和氯离子,碘遇到淀粉变蓝,离子方程式为Cl2+2I-=I2+2Cl-;
(4)由于氯化铁的熔点较低,容易冷凝堵塞导管,则双通管F中玻璃纤维(不参与反应)的作用是防止氯化铁堵塞后面的导管;氯化铁易吸水潮解,为防止H中的水蒸气进入F中,使五水三氯化铁潮解,所以应在F和H装置之间安装G装置;
(5)氯气有毒直接排放能够引起环境污染,氯气能够与氢氧化钠容易反应,H中NaOH溶液的作用是吸收多余的氯气,防止空气污染。

【题目】I.25℃时,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)HA是________酸(选填“强”、“弱”)。NaA的水溶液显________性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
(5)在C点所得混合溶液中,下列说正确的是:___________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+) >c(A-)>c(H+)> c(OH-)。
C.c(Na+) +c(H+)=c(A─) +c(OH-)
D.c(HA)+c(A-)=0.2mol·L-1
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
(3)在25 ℃的条件下,向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。





