��Ŀ����
����Ŀ��CH3OH ��һ����ɫ�д̼�����ζ��Һ�壬����������������Ҫ��;��
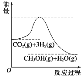
��.Ŀǰ��ҵ����һ�ַ������� CO2 ����ȼ�ϼ״���һ�������·�����Ӧ��CO2(g) +3H2(g)=CH3OH(g)+H2O(g)���÷�Ӧ�������仯��ͼ��ʾ��
(1)����Ϊ�÷�ӦΪ_____(����Ȼ�����)��Ӧ.
(2)���������У��������Ϸ�Ӧ���ܼӿ췴Ӧ���ʵ���_____��
a�������¶� b������ He c��������� d������ѹǿ
��. CH3OH Ҳ��һ����Ҫ��ȼ�ϣ�һ�������·�����Ӧ��
2CH3OH(g)��3O2(g) =2 CO2(g)��4H2O(g)��
(3)ij�¶��£��� 4mol CH3OH �� 6 mol O2 ���� 2 L ���ܱ������о��� 4 min ��Ӧ�ﵽƽ�⣬��� c(O2)��1.5mol��L��1��4 min ��ƽ����Ӧ���� ��(H2O)��_____��
(4)CH3OH ȼ�ϵ����Ŀǰ������ɹ���ȼ�ϵ��֮һ������ȼ�ϵ���ɼ״�������(����)��KOH(�������Һ)���ɡ�������˵����ȷ����_____(�����)��
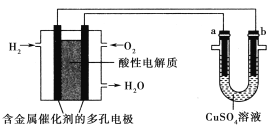
�ٵ�طŵ�ʱͨ������ĵ缫Ϊ����
�ڵ�طŵ�ʱ���������Һ�ļ�������
�۵�طŵ�ʱÿ���� 6.4 g CH3OH ת�� 1.2 mol ����
(5)�� CH3OH������(����)������������ҺΪԭ�ϣ�ʯīΪ�缫����ȼ�ϵ�أ��õ���и����ϵĵ缫��Ӧʽ�ǣ�____________________________��
���𰸡����� ac 0.5mol��(L��min)-1 �ڢ� CH3OH+8OH--6e-=CO32-+6H2O
��������
��.(1)��Ϸ�Ӧ������������������С�Ƚ��жϷ�Ӧ���Ȼ����ȣ�
(2)���ݸı���������Ի�ѧ��Ӧ���ʵ�Ӱ����з������
��.(3)���ݹ�ʽ![]() ����O2�Ļ�ѧ��Ӧ���ʣ��ٽ�ϻ�ѧ�������뻯ѧ��Ӧ���ʳ����ȼ���H2O�Ļ�ѧ��Ӧ���ʣ�
����O2�Ļ�ѧ��Ӧ���ʣ��ٽ�ϻ�ѧ�������뻯ѧ��Ӧ���ʳ����ȼ���H2O�Ļ�ѧ��Ӧ���ʣ�
(4)��(5)CH3OHȼ�ϵ���У�KOH���������Һ��CH3OH��������ʧȥ���ӷ���������Ӧ���缫��ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��O2���������õ����ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+4e-+2H2O=4OH-���ݴ˷������
��. (1)����ͼ���֪����Ӧ������������������������������˸÷�ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
(2)���������У����ڷ�ӦCO2(g) +3H2(g)=CH3OH(g)+H2O(g)��
a�������¶ȣ���ѧ��Ӧ���ʼӿ죬a�������⣻
b�����������³���He�������ʵ�Ũ�Ȳ��䣬��ѧ��Ӧ���ʲ������ı䣬b���������⣻
c����������ɽ��ͷ�Ӧ�Ļ�ܣ���ѧ��Ӧ���ʼӿ죬c�������⣻
d������ѹǿ��ѧ��Ӧ���ʼ�����d���������⣻
�ʴ�Ϊ��ac��
��.(3)��4min��O2ת�������ʵ���Ϊxmol������6mol-xmol=1.5mol/L��2L��x=3���� ���ɻ�ѧ��Ӧ�����뻯ѧ�����������ȿɵ���(O2)����(H2O)=3��4������(H2O)=
���ɻ�ѧ��Ӧ�����뻯ѧ�����������ȿɵ���(O2)����(H2O)=3��4������(H2O)=![]() ��(O2)=
��(O2)=![]() ��0.375mol��L-1��min-1=0.5 mol��L-1��min-1���ʴ�Ϊ��0.5mol��L-1��min-1��
��0.375mol��L-1��min-1=0.5 mol��L-1��min-1���ʴ�Ϊ��0.5mol��L-1��min-1��
(4)�ٸ�������������֪����طŵ�ʱ��O2����������ͨ������ĵ缫Ϊ�������ٴ���
�ڵ�طŵ�ʱ����ص��ܷ�ӦΪ2CH3OH+3O2+4OH-=2CO32-+6H2O���������Һ��OH-���ϱ����ģ���������������ȷ��
�۵�طŵ�ʱ��������ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��6.4gCH3OH��������Ϊ6.4g��32g/mol=0.2mol��ÿ����0.2molCH3OHת��0.2mol��6=1.2mol���ӣ�����ȷ��
�ʴ�Ϊ���ڢۣ�
(5)��������������֪��CH3OHȼ�ϵ���У�KOH���������Һ��CH3OH��������ʧȥ���ӷ���������Ӧ���缫��ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��

 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ�������������ڽ����ơ�������Ͷ�������Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մ����ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ1��ʾ��
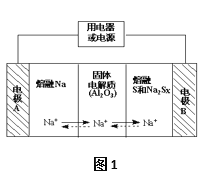

��1�����ݱ����ݣ������жϸõ�ع���������Ӧ����
��_____������ĸ����Χ����
A��100������ B��100��300��
C��300��350�� D��350��2050��
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050 |
�е�/�� | 892 | 444.6 | 2980 |
��2���ŵ�ʱ���缫AΪ_____�����缫B����_____��Ӧ������������ԭ������
��3�����ʱ���ܷ�ӦΪNa2Sx��2Na+xS���������ĵ缫��ӦʽΪ��________________��
��4��������������Ϊ��Դ��������װ��KI��������Һ��ͼ2��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ��________________���Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ�___________________��
����Ŀ������п�̵�����ճ����������������ĵ�أ��乹����ͼ��ʾ���ŵ�ʱ�ܷ�ӦΪ��Zn+2H2O+2MnO2=Zn(OH)2+2MnOOH��
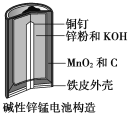
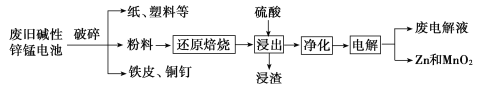
�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ�����ͼ��ʾ��
�ش��������⣺
(1)MnOOH�У�MnԪ�صĻ��ϼ�Ϊ_________��
(2)����ԭ�����������У��۽��������ﱻ��ԭΪ�ͼ���������������(����MnOOH��MnO2����ԭ��MnO)����Ҫԭ�������������к���_________��
(3)����������Ϊ�˳�ȥ����Һ�е�Fe2���������ǣ�����______(�ѧʽ)��Һ��Fe2������ΪFe3�����ٵ���pHʹFe3��������ȫ�������£���֪����Һ��Mn2����Zn2����Ũ��ԼΪ0.1 mol/L�������������ݼ��㣬����pH�ĺ�����Χ��______��__________��(����Ũ��С��1��10��5 mol/L��Ϊ������ȫ)
������ | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10��13 | 10��17 | 10��38 |
(4)�������ʱ�������ĵ缫��ӦʽΪ_________����������Ӧѭ�����õ�������_______(�ѧʽ)��
(5)������������ֱ�������Ṳ�ȷ�Ӧ����ˣ���Һ����Ҫ�ɷ���ZnCl2��MnCl2��������һ�ֻ���ɫ���壬���������е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ__________��