题目内容
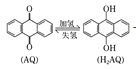
【题目】Ⅰ.已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1,H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为_______。
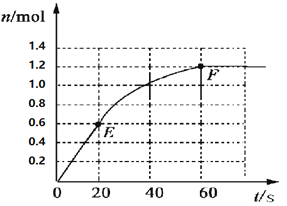
Ⅱ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为___________________ 。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是____________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示,则K1、K2、K3之间的大小关系为___________。
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
【答案】+130 kJ/mol A+2B![]() 2C 升高温度 a K1>K2=K3
2C 升高温度 a K1>K2=K3
【解析】
I.根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=H(产物)-H(反应物),再结合化学键能和物质能量的关系来回答;
II.(1)根据图知,A、B为反应物而C为生成物,3min内△n(A)=(1-0.7)mol=0.3mol、△n(B)=(1-0.4)mol=0.6mol、△n(C)=(0.6-0)mol=0.6mol,相同时间内各物质的物质的量变化量之比等于其计量数之比,则A、B、C的计量数之比=0.3mol:0.6mol:0.6mol=1:2:2;
(2)①达平衡后,降低温度,A的体积分数将减小,说明降低温度,化学平衡正向移动,该反应的正反应为放热反应,t3时刻改变条件时正、逆反应速率都增大且逆反应速率大于正反应速率,平衡逆向移动;
②t3时刻平衡逆向移动,t5时刻正逆反应速率都增大但仍然相等,平衡不移动;
③该反应的正反应为放热反应,升高温度平衡逆向移动,化学平衡常数减小;温度不变,化学平衡常数不变。
I. 已知①C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1>0,
②2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1
①×2-②得:2 H2O(g)=O2(g)+2H2(g) △H=(2a+220)kJmol-1>0,4×462-496-2×436=2a+220,
解得a=+130kJ/mol;
II.(1)根据图知,A、B为反应物而C为生成物,3min内△n(A)=(1-0.7)mol=0.3mol、△n(B)=(1-0.4)mol=0.6mol、△n(C)=(0.6-0)mol=0.6mol,相同时间内各物质的物质的量变化量之比等于其计量数之比,则A、B、C的计量数之比=0.3mol:0.6mol:0.6mol=1:2:2,最终各种物质都存在,且物质的量浓度不再发生变化,说明反应为可逆反应,该反应方程式为A+2B![]() 2C;
2C;
(2)①达平衡后,降低温度,A的体积分数将减小,说明降低温度,化学平衡正向移动,根据平衡移动原理:降低温度,平衡向放热反应分析移动,则该反应的正反应为放热反应,t3时刻改变外界条件时,正、逆反应速率都增大,且逆反应速率大于正反应速率,化学平衡逆向移动,则改变的条件是升高温度;
②t3时刻平衡逆向移动,t5时刻改变外界条件后,正、逆反应速率都增大但仍然相等,说明化学平衡不移动。平衡正向移动C的体积分数增大,平衡逆向移动,C的体积分数减小,所以a、b、c三点中C体积分数最大的是a点;
③该反应的正反应为放热反应,升高温度,平衡逆向移动,化学平衡常数减小;温度不变,化学平衡常数不变。由于反应温度:T(t2~t3)<T(t4~t5)=T(t5~t6),所以化学平衡常数K1>K2 =K3。