题目内容
【题目】二氧化碳加氢合成乙烯的反应如下:2CO2(g )+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。
C2H4(g)+4H2O(g) ΔH。
已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(1)ΔH2=bkJ/mol;
③H2O(1)=H2O(g) ΔH3=c kJ/mol;
请回答:
(1)ΔH=____kJ/mol。(用a、b、c 表示)
(2)在催化剂[Fe3(CO)12/ZSM-5]、空速1200 h-1 条件下,温度、压强、氢碳比[n(H2)/n(CO2)=x]对CO2平衡转化率及温度对催化效率影响如图1所示。
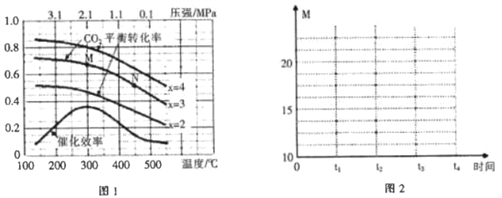
①下列有关说法正确的是________(填字母)。
A.ΔH>0
B.增大氢碳比,可以提高CO2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的产率增大
D.平衡常数:K(M)>K(N)
E.为提高CO2的平衡转化率,工业生产中应在尽可能低的温度下合成乙烯
②M点时,CO2的平衡转化率为2/3,则此时平衡体系中乙烯的体积分数为_________。
③工业生产中压强一般控制在2.1~2.6 MPa之间,理由是____________________________。
(3)恒温(300℃),在体积为1L的恒容容器中以n(H2)/n(CO2)=3的投料比加入反应物,至t1时达到平衡。t2时将容器体积瞬间扩大至2 L并保持不变,t3时重新达平衡。在图2中绘制0~t4时间段内,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像。_______
【答案】 3b+4c-a B D 1/9或11.1% 压强小于2.1MPa,CO2的平衡转化率较小;压强大于2.6MPa,CO2的平衡转化率提高幅度较小,运行成本增加  [起点12.5,t2低于20(实际为16.7),t3高于12.5]
[起点12.5,t2低于20(实际为16.7),t3高于12.5]
【解析】(1) 已知:①C2H4(g)+3O2(g)=2CO2(g)+2H2 ΔH1=akJ/mol;②2H2(g)+O2(g)=2H2O(1) ΔH2=bkJ/mol;③H2O(1)=H2O(g) ΔH3=ckJ/mol;根据盖斯定律,将②×3+③×4-①得:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=(3b+4c-a )kJ/mol,故答案为:3b+4c-a;
C2H4(g)+4H2O(g) ΔH=(3b+4c-a )kJ/mol,故答案为:3b+4c-a;
(2)①A.根据图像,CO2平衡转化率随温度升高而降低,说明升高温度,平衡逆向移动,正反应为放热反应,ΔH<0,故A错误;B.根据方程式2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g),增大氢碳比(
C2H4(g)+4H2O(g),增大氢碳比(![]() ),可以提高CO2的平衡转化率,故B正确;C.根据A的分析,ΔH<0,温度升高,平衡逆向移动,乙烯的产率降低,故C错误;D.升高温度,平衡逆向移动,平衡常数减小,则平衡常数:K(M)>K(N),故D正确;E.根据图像,为提高CO2的平衡转化率,工业生产中应在300℃温度下合成乙烯,温度太低,催化剂的活性较低,反应速率太慢,故E错误;故选BD;
),可以提高CO2的平衡转化率,故B正确;C.根据A的分析,ΔH<0,温度升高,平衡逆向移动,乙烯的产率降低,故C错误;D.升高温度,平衡逆向移动,平衡常数减小,则平衡常数:K(M)>K(N),故D正确;E.根据图像,为提高CO2的平衡转化率,工业生产中应在300℃温度下合成乙烯,温度太低,催化剂的活性较低,反应速率太慢,故E错误;故选BD;
②设参与反应的二氧化碳的物质的量为3n,则氢气为9n,根据反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)可知,CO2的平衡转化率为2/3,平衡时n(CO2)=n mol,n(H2)=3nmol,n(C2H4)=nmol,n (H2O)=4nmol,平衡体系中乙烯的体积分数=物质的量分数=
C2H4(g)+4H2O(g)可知,CO2的平衡转化率为2/3,平衡时n(CO2)=n mol,n(H2)=3nmol,n(C2H4)=nmol,n (H2O)=4nmol,平衡体系中乙烯的体积分数=物质的量分数=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
③根据图像,工业生产中压强一般控制在2.1~2.6MPa之间,是因为压强小于2.1MPa,CO2的平衡转化率较小;压强大于2.6MPa,CO2的平衡转化率提高幅度较小,运行成本增加,故答案为:压强小于2.1MPa,CO2的平衡转化率较小;压强大于2.6MPa,CO2的平衡转化率提高幅度较小,运行成本增加;
(3) 设参与反应的二氧化碳的物质的量为3mol,则氢气为9mol,起始时混合气体的平均相对分子质量(M)= ![]() =12.5;300℃时,CO2的平衡转化率为2/3,根据反应2CO2(g)+6H2(g)
=12.5;300℃时,CO2的平衡转化率为2/3,根据反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)可知,平衡时n(CO2)=1mol,n(H2)=3mol,n(C2H4)=1mol,n (H2O)=4mol,混合气体的平均相对分子质量(M)=
C2H4(g)+4H2O(g)可知,平衡时n(CO2)=1mol,n(H2)=3mol,n(C2H4)=1mol,n (H2O)=4mol,混合气体的平均相对分子质量(M)= ![]() =16.67;t2时将容器体积瞬间扩大至2L并保持不变,平衡逆向移动,气体的物质的量增大,但小于12mol,新平衡时混合气体的平均相对分子质量(M)减小,但大于12.5,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像为
=16.67;t2时将容器体积瞬间扩大至2L并保持不变,平衡逆向移动,气体的物质的量增大,但小于12mol,新平衡时混合气体的平均相对分子质量(M)减小,但大于12.5,容器内混合气体的平均相对分子质量(M)随时间(t)变化的图像为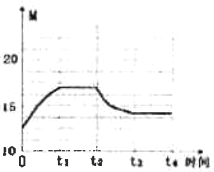 [起点12.5,t2低于20(实际为16.7),t3高于12.5],故答案为:
[起点12.5,t2低于20(实际为16.7),t3高于12.5],故答案为: [起点12.5,t2低于20(实际为16.7),t3高于12.5]。
[起点12.5,t2低于20(实际为16.7),t3高于12.5]。

 习题精选系列答案
习题精选系列答案