题目内容
【题目】某离子化合物M(仅含三种元素)是一种镁基储氢材料。为探究M的组成和性质,设计并完成如下实验:
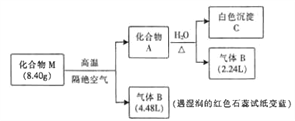
已知:气体的体积均在标准状况下测定,化合物A仅含两种元素。
请回答:
(1)化合物M中阳离子和阴离子的个数比为1:2,则M的化学式为_______________。
(2)化合物A 与H2O反应的化学方程式_______________。
(3)镁条在足量的气体B中燃烧可生成化合物M 和气体D,则D的分子式为_______________。
(4)研究表明液态B也是一种良好的储氢物质,其储氢容量可达17.6%,已知液态B中存在类似水的电离(2H2O![]() H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
H3O++OH-),用Pt电极对液态B进行电解可产生两种气态单质。
①液态B的电离方程式________________。
②电解时,阴极的电极反应式________________。
【答案】 Mg(NH2)2 Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑ H2 2NH3=NH4++NH2- 2NH3+2e-=H2↑+2NH2-或2NH4++2e-=H2↑+2NH3
3Mg(OH)2↓+2NH3↑ H2 2NH3=NH4++NH2- 2NH3+2e-=H2↑+2NH2-或2NH4++2e-=H2↑+2NH3
【解析】气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,气体的体积均在标准状况下测定,某物质M (仅含三种元素)是一种镁基储氢材料,M高温分解生成固体A和气体B为氨气,物质的量=![]() =0.2mol,证明M中含有N、H、Mg元素,化合物A只含两种元素,和水反应生成氨气和白色沉淀C,固体A和水反应生成氨气物质的量=
=0.2mol,证明M中含有N、H、Mg元素,化合物A只含两种元素,和水反应生成氨气和白色沉淀C,固体A和水反应生成氨气物质的量=![]() =0.1mol,白色沉淀C为氢氧化镁沉淀,则A为Mg3N2,物质的量为0.05mol,元素守恒得到Mg元素物质的量0.15mol,所含氮元素0.1mol,M分解生成氨气0.2mol,则M中含氮元素0.2mol+0.1mol=0.3mol,所含氢元素物质的量=
=0.1mol,白色沉淀C为氢氧化镁沉淀,则A为Mg3N2,物质的量为0.05mol,元素守恒得到Mg元素物质的量0.15mol,所含氮元素0.1mol,M分解生成氨气0.2mol,则M中含氮元素0.2mol+0.1mol=0.3mol,所含氢元素物质的量=![]() =0.6mol,M中元素物质的量之比为:n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4。
=0.6mol,M中元素物质的量之比为:n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4。
(1)化合物M中阳离子和阴离子的个数比为1:2,M中元素物质的量之比为:n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4,则M的化学式为Mg(NH2)2,故答案为:Mg(NH2)2;
(2)化合物A为Mg3N2,与H2O反应的化学方程式为Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O
3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O![]() 3Mg(OH)2↓+2NH3↑;。
3Mg(OH)2↓+2NH3↑;。
(3)镁条在足量的氨气中燃烧可生成化合物M[Mg(NH2)2]和气体D,在M中n(N):n(H)=1:2,而氨气中n(N):n(H)=1:3,则D中含有H元素,分子式为H2,故答案为:H2;
(4) ①液态氨中存在类似水的电离(2H2O![]() H3O++OH-),则氨的电离方程式为2NH3=NH4++NH2-,故答案为:2NH3=NH4++NH2-;
H3O++OH-),则氨的电离方程式为2NH3=NH4++NH2-,故答案为:2NH3=NH4++NH2-;
②用Pt电极对液态B进行电解可产生两种气态单质,分别为氮气和氢气,电解时,阴极发生还原反应,电极反应式为2NH4++2e-=H2↑+2NH3,故答案为:2NH4++2e-=H2↑+2NH3。

 优等生题库系列答案
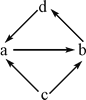
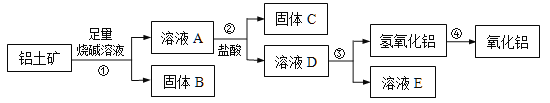
优等生题库系列答案【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. ①②③ B. ③④
C. ①③④ D. ②④