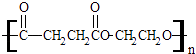题目内容
【题目】选考(13分)(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为____。PAN中四种元素的第一电离能由大到小的顺序为__________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,
心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是___________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键
b.共价键
c.配位键
d.范德华力
e.氢键
②NH4NO3中阳离子的空间构型为_____,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。

【答案】(1)①10NA(或6.02×1024)(1分);N>O>C>H(2分)
②6(1分);1s22s22p63s23p63d6(或[Ar] 3d6)
(1分 ③高(1分);HCOOH分子间能形成氢键(1分)
(2)①de(2分) ②正四面体形(1分);sp2 (1分) (3)3(2分)
【解析】
试题分析:(1)①单键都是σ键,双键是由1个σ键和1个![]() 组成的,则根据PAN的结构简式可知1mol PAN中含有的σ键数目为10NA(或6.02×1024)。非金属性越强第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,因此PAN中四种元素的第一电离能由大到小的顺序为N>O>C>H。
组成的,则根据PAN的结构简式可知1mol PAN中含有的σ键数目为10NA(或6.02×1024)。非金属性越强第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,因此PAN中四种元素的第一电离能由大到小的顺序为N>O>C>H。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,其中NO和水是配体,则该配合物中中心离子的配位数为6;亚铁离子核外电子数是24个,则根据核外电子排布规律可知中心离子的核外电子排布式为1s22s22p63s23p63d6(或[Ar] 3d6)。
③由于HCOOH分子间能形成氢键,二甲醚中不存在氢键,因此相同压强下,HCOOH的沸点比CH3OCH3高。
(2)①(NH4)2SO4是离子化合物,存在离子键、共价键,另外氮元素与氢元素之间还有配位键,则晶体中各种微粒间的作用力不涉及的是范德华力和氢键,答案选de。
②NH4NO3中阳离子是铵根,氮元素不存在孤对电子,价层电子对数是4,则空间构型为正四面体形;阴离子是硝酸根,其中氮元素也不存在孤对电子,其价层电子对数是3,所以中心原子轨道采用sp2杂化。
(3)根据Kr晶体的晶胞结构图可知,晶体中以顶点为中心,与每个Kr原子紧相邻的Kr原子有![]() 个,即m=12.晶胞中Kr原子为n个,则n=
个,即m=12.晶胞中Kr原子为n个,则n=![]() ,所以m/n=3。
,所以m/n=3。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】实验室可用草酸(H2C2O4)在浓硫酸的作用下分解得一氧化碳,某研究小组利用如图所示装置探究温度对CO还原Fe2O3的影响(固定装置略):

(1)草酸(H2C2O4)在浓硫酸的作用下分解制取一氧化碳的化学方程式为_____________________。
(2)装置C的作用是_______________,加热D装置之前需进行的操作是___________________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀硫酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①甲组步骤1中反应的化学方程式为_________________________。
②甲组步骤3中,溶液变红的离子方程式为______________________。
③乙组得到的黑色粉末是_____________(填化学式)。
④乙组步骤4中,溶液褪色可能的原因及其验证方法为_______________________。
(4)该装置的改进措施除了在E装置后加尾气处理装置外还需_______________________。
【题目】实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·5H2O),方案如下:

金属离子生成氢氧化物沉淀的pH可参考下列数据:
Fe3+ | Fe2+ | Cu2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 5.2 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 6.7 | 4.7 |
请回答:
(1)若溶解合金时加入的混酸由2 L 3 mol·L-1硫酸和1 L 2 mol·L-1硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________L。
(2)加入H2O2的目的是____________。
(3)为保证产品的纯度,M物质最好选用________(填字母),调节pH的范围为____________。
a.Cu(OH)2 b.H2SO4 c.NH3·H2O d.Na2CO3
(4)滤液D中加入硫酸的目的为_______________________________________。
(5)从溶液E制得CuSO4·5H2O晶体所需要的步骤为________、结晶、过滤和干燥。
(6)0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。试确定200℃时固体物质的化学式______________。