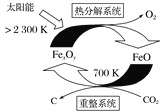
题目内容
【题目】工业合成氨的反应:N2(g)+3H2(g) ![]() 2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N
2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N![]() N键放出的能量分别为436KJ、391KJ、946KJ。则:
N键放出的能量分别为436KJ、391KJ、946KJ。则:
(1)若1mol N2完全反应生成NH3可______(填“吸收”或“放出)热量_____KJ。
(2)如果将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是_____________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是________mol·L -1·min-1。
(4)一定条件下,当成合成氨反应达到化学平衡时,下列说法正确的是(____)
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d. N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
【答案】 放出 92 可逆反应,不可能完全反应 0.25 acf
【解析】试题分析:(1)根据焓变=反应物的总键能-生成物的总键能计算; (2) 可逆反应,不可能完全反应。
(3)根据![]() 计算N2表示的化学反应速率。
计算N2表示的化学反应速率。
(4)化学平衡定义判断正误。
解析:根据以上分析,(1) N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)![]() ,所以若1mol N2完全反应生成NH3可放出热量92KJ。
,所以若1mol N2完全反应生成NH3可放出热量92KJ。
(2) 可逆反应,不可能完全反应,所以将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总,92KJ。
(3)在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则消耗氮气5mol,用N2表示的化学反应速率是![]() mol·L -1·min-1。
mol·L -1·min-1。
(4) a. 达到化学平衡时,正反应速率和逆反应速率一定相等,故a正确;
b. 达到化学平衡时,正反应速率和逆反应速率一定相等,故b错误;
c. 达到化学平衡时,即达到反应最大限度,N2的转化率达到最大值,故c正确;
d. 达到化学平衡时,N2和H2的浓度不再改变,但不一定相等,故d错误;
e. 达到化学平衡时,N2、H2和NH3的体积分数不变,但不一定相等,故e错误;
f. 达到化学平衡时,反应达到最大限度,故f正确。

【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
② 52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③ C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢
硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。