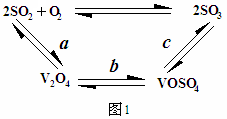
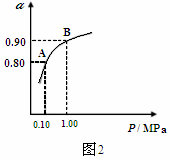
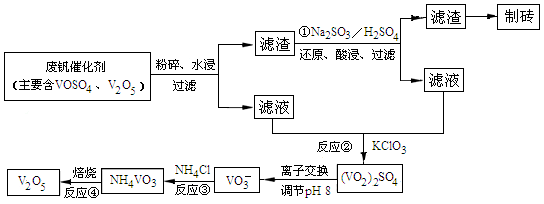
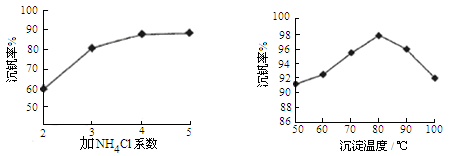
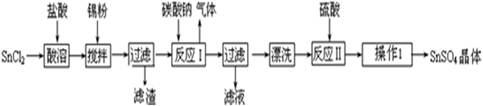
题目内容
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: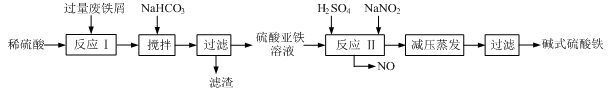
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 ,此时溶液中存在的阳离子主要有 ,用NaHCO3调整溶液pH时的离子方程式是 。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,同时通入O2的作用是 。
(3)碱式硫酸铁溶于水后能电离产生[Fe(OH)]2+离子,写出[Fe(OH)]2+发生水解反应生成Fe(OH)3的离子方程式 。
(4)已知废铁屑中铁元素的质量分数为84.0%,若不考虑每步反应中铁元素的损耗,现有100吨废铁屑理论上最多能生产 吨碱式硫酸铁。
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+(2分,答对一点即可得2分,其它合理答案也可) Fe2 +、Al3+(2分); 3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓ (2分)
(2)作氧化剂并且可减少污染性气体的排放(其他合理答案也可,1分)
(3)[Fe(OH)]2++2H2O Fe(OH)3 + 2H+ (2分)
Fe(OH)3 + 2H+ (2分)
(4)253.5 (2分)
解析试题分析:(1)把废铁屑加入稀硫酸中,所以其作用为:使硫酸充分反应掉或提高硫酸利用率或使Fe3+尽可能转化为Fe2+;废铁屑还含有Al2O3,所以与H2SO4反应后的溶液含Fe2 +、Al3+;加入NaHCO3后与Al3+发生相互促进的水解反应:3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓。
(2)NaNO2氧化Fe2+会生成NO,造成污染,而O2氧化Fe2+产物无污染,所以O2的作用为:作氧化剂并且可减少污染性气体的排放。
(3)[Fe(OH)]2+结合H2O电离的OH?生成Fe(OH)3,离子方程式为:[Fe(OH)]2++2H2O Fe(OH)3 + 2H+
Fe(OH)3 + 2H+
(4)根据Fe元素守恒可知:Fe ~ Fe(OH)SO4 100吨废铁屑理论上可生成碱式硫酸铁的质量为:100×84.0%÷56×169=253.5吨。
考点:本题考查试剂的用途、产物的判断与产量的计算、离子方程式的书写。

金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是 (用离子方程式表示),检验副产品甲是否变质的实验方法是 。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:__________________________________________________________________
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应控制的反应条件是__________________________
(6)在800--1000℃时电解TiO2也可制得海绵钛,装置如图所示。图中b是电源的______极,阴极的电极反应式________________。

丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶
 ,反应温度 ℃。
,反应温度 ℃。 (2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈____性(“酸”、“碱”、“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中为:继续加入H2SO4,________冷却结晶,过滤。继续加入H2SO4目的是________________________。
已知:①除去滤渣II后,溶液中存在如下反应:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式____________________________。
下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2 CaCO3↓+2NaOH CaCO3↓+2NaOH |
B.乙醇:C6H12O6 2C2H5OH+2CO2↑ 2C2H5OH+2CO2↑ |
C.二氧化硫:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
D.氯气:Ca(ClO)2+4HCl(浓) CaCl2+2Cl2↑+2H2O CaCl2+2Cl2↑+2H2O |
 Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。