题目内容
3.25℃时,已知Ksp[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,若要生成Cu(OH)2沉淀,应调整溶液的pH值大于( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.
解答 解:某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥$\sqrt{\frac{2×1{0}^{-14}}{0.02}}$mol/L=10-9mol/L,则c(H+)≤$\frac{1×1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5,所以应调节pH大于5,
故选D.
点评 本题考查溶度积常数的计算,题目难度不大,注意把握计算公式的运用.

练习册系列答案
相关题目
1.下列不能用勒沙特列原理解释的是( )
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 实验室制备乙酸丁酯时使用过量乙酸 | |
| C. | 加热蒸干氯化铁的溶液,得到氢氧化铁固体 | |
| D. | 氯化银悬浊液中加入硫化钠溶液,产生黑色沉淀 |
11.下表是元素周期表的一部分,据此请回答下列问题.
(1)化学性质最不活泼的是(填元素符号,下同)He,金属性最强的是Na,非金属性最强的是F,电负性最大的是F,第一电离能最小的是Na;
(2)A、B、C、G四种元素的最高价氧化物对应水化物,其中碱性最强的是NaOH(填化学式,下同),属于两性氢氧化物的是Al(OH)3,酸性最强的是HClO4;
(3)第3周期各元素中,属于金属元素且原子半径最小的是Al(填元素符号,下同),熔点最低的是Na,还原性最强的是Na;
(4)E元素的氢化物是H2O(填化学式),该氢化物在常温下跟A单质发生反应的化学方程式是2Na+2H2O=2NaOH+H2↑,所得溶液的pH>7;(填“<”“>”或“=”)
(5)G元素和A元素形成的化合物属于离子晶体.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
(2)A、B、C、G四种元素的最高价氧化物对应水化物,其中碱性最强的是NaOH(填化学式,下同),属于两性氢氧化物的是Al(OH)3,酸性最强的是HClO4;
(3)第3周期各元素中,属于金属元素且原子半径最小的是Al(填元素符号,下同),熔点最低的是Na,还原性最强的是Na;
(4)E元素的氢化物是H2O(填化学式),该氢化物在常温下跟A单质发生反应的化学方程式是2Na+2H2O=2NaOH+H2↑,所得溶液的pH>7;(填“<”“>”或“=”)
(5)G元素和A元素形成的化合物属于离子晶体.
8.还原沉淀法是处理含铬(Cr2O72-和CrO42-)废水常用方法,过程如下:
CrO42-$\stackrel{H+}{→}$Cr2O72-$\stackrel{Fe_{2}+}{→}$Cr3+$\stackrel{OH-}{→}$Cr(OH)3
已知废水中Cr的含量为26.0g•L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32.有关叙述中不正确的是( )
CrO42-$\stackrel{H+}{→}$Cr2O72-$\stackrel{Fe_{2}+}{→}$Cr3+$\stackrel{OH-}{→}$Cr(OH)3
已知废水中Cr的含量为26.0g•L-1,当溶液中离子浓度小于10-5mol/L时认为离子已经沉淀完全,常温下,Ksp[Cr(OH)3]=1×10-32.有关叙述中不正确的是( )
| A. | 上述三个转化中只有一个涉及氧化还原反应 | |
| B. | 第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ | |
| C. | 处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 | |
| D. | 当pH≥5时,废水中铬元素沉淀完全 |
15.下列反应的离子方程式书写正确的是( )
| A. | 胃舒平(主要含氢氧化铝)治疗胃酸过多:OH-+H+═H2O | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 敞口的澄清石灰水变质:Ca2++2OH-+2CO2═Ca(HCO3)2 | |
| D. | 稀盐酸除铁锈:6H++Fe2O3═2Fe3++3H2O |
13.短周期元素X、Y、Z,在周期表中的位置如图所示,则下列说法错误的是( )


| A. | X单质最稳定 | B. | Y的氢化物为HY | ||
| C. | Z单质常温下是淡黄色固体 | D. | 能生成HXO |
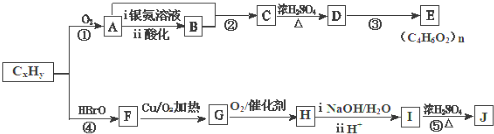

 .
.
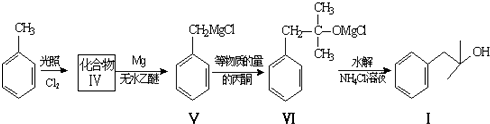
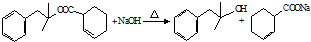 .
.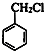 ,生成化合物Ⅳ的反应类型为取代反应.
,生成化合物Ⅳ的反应类型为取代反应.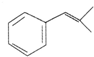 或
或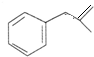 .
. 也能发生类似Ⅴ→Ⅵ的反应生成化合物Ⅶ,则Ⅶ的结构简式为
也能发生类似Ⅴ→Ⅵ的反应生成化合物Ⅶ,则Ⅶ的结构简式为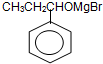 .
.