题目内容
11.下表是元素周期表的一部分,据此请回答下列问题.| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
(2)A、B、C、G四种元素的最高价氧化物对应水化物,其中碱性最强的是NaOH(填化学式,下同),属于两性氢氧化物的是Al(OH)3,酸性最强的是HClO4;
(3)第3周期各元素中,属于金属元素且原子半径最小的是Al(填元素符号,下同),熔点最低的是Na,还原性最强的是Na;
(4)E元素的氢化物是H2O(填化学式),该氢化物在常温下跟A单质发生反应的化学方程式是2Na+2H2O=2NaOH+H2↑,所得溶液的pH>7;(填“<”“>”或“=”)
(5)G元素和A元素形成的化合物属于离子晶体.
分析 由元素在周期表中位置可知,A为Na、N为Mg、C为Al、D为碳、E为O、F为氟、G为Cl、H为He.
(1)稀有气体的性质最不活泼;同周期自左而右金属性减弱、非金属性增强、电负性增大、第一电离能呈增大趋势,同主族自上而下金属性增强、非金属性减弱、电负性减小、第一电离能减小;
(2)金属性越强,最高价氧化物对应水化物的碱性越强,氢氧化铝属于两性氢氧化物,高氯酸的酸性最强;
(3)同周期自左而右原子半径减小;离子半径越小、电荷越大,金属键越强,金属晶体的熔点越高;金属性越强,单质的还原性越强;
(4)E元素的氢化物是为H2O,常温下跟Na单质反生成氢氧化钠与氢气,所得溶液呈碱性;
(5)G元素和A元素形成的化合物为NaCl.
解答 解:由元素在周期表中位置可知,A为Na、N为Mg、C为Al、D为碳、E为O、F为氟、G为Cl、H为He.
(1)稀有气体He的性质最不活泼;同周期自左而右金属性减弱、非金属性增强、电负性增大、第一电离能呈增大趋势,同主族自上而下金属性增强、非金属性减弱、电负性减小、第一电离能减小,故金属性最强的是Na,非金属性最强的是F,电负性最大的是F,第一电离能最小的是Na,
故答案为:He;Na;F;F;Na;
(2)四种元素中Na的金属性最强,故最高价氧化物对应水化物中NaOH的碱性越强,Al(OH)3属于两性氢氧化物,HClO4的酸性最强;
故答案为:NaOH;Al(OH)3;HClO4;
(3)同周期自左而右原子半径减小,第3周期金属元素原子半径:Na>Mg>Al,离子半径:Na+>Mg2+>Al3+,离子所带电荷:Na+<Mg2+<Al3+,故金属键Na<Mg<Al,故Na的熔点最大,Na的金属性最强,故Na单质的还原性越强,
故答案为:Al;Na;Na;
(4)E元素的氢化物是为H2O,常温下跟Na单质反生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,所得溶液呈碱性,即pH>7;
故答案为:H2O;2Na+2H2O=2NaOH+H2↑;>;
(5)G元素和A元素形成的化合物为NaCl,属于离子晶体,故答案为:离子.
点评 本题考查元素周期表与元素周期律,比较基础,注意对元素周期律的理解掌握.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案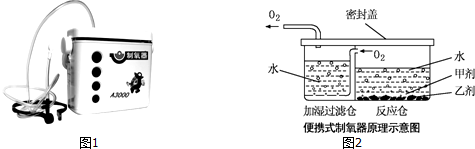
【提出问题】甲剂的化学成分是什么?
【阅资料】过碳酸钠是白色颗粒状固体,溶于水时,生成碳酸钠和过氧化氢,可用于制取氧气.
【设计与实验】小雨把甲剂和乙剂带到实验室与黄老师共同探究.在老师的指导下,验证出甲剂是一种钠盐后,小雨接着进行如下实验:
[实验一]用甲剂和乙剂制取并验证氧气.
(1)根据图2得出:组装气体发生装置时应选择图3所示的仪器:ABCFG 或ACEG(填字母),该装置还可用于制取的气体是氢气、二氧化碳;
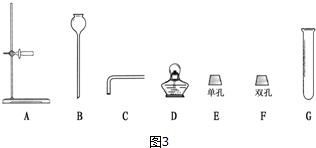
(2)装置连接完毕,装药品前应先检查装置的气密性;
(3)小雨认为氧气是由过氧化氢在乙剂催化下产生的,其化学方程式为2H2O2 $\frac{\underline{\;乙剂\;}}{\;}$2H2O+O2↑;
(4)检验氧气的方法是将带火星的木条伸入集气瓶内,木条复燃.
[实验二]检验上述反应后的溶液中是否含有碳酸根离子.
| 检验步骤 | 实验操作 | 实验现象 | 结论 | |
| 步骤一 | 取少量反应后的溶液,加入稀盐酸 | 有气泡产生 | ||
| 步骤二 | 将步骤一产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
【反思与评价】小方认为小雨的结论不够严密,你认为严密的结论应该是甲剂一定含有钠、碳和氧三种元素(或甲剂可能是过碳酸钠).
| A. | 已知可逆反应:2SO2+O2?2SO3,当O2的消耗速率与SO3的消耗速率之比为1:2时,表明该可逆反应达到化学平衡状态 | |
| B. | 由Zn、Cu、稀硫酸组成的原电池,负极为Zn,发生还原反应,电极反应式为:Zn-2e-=Zn2+ | |
| C. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| D. | 甲苯的一氯代物有4种,则甲苯与足量H2发生加成反应后所得到的有机产物的一氯代物也只有4种 |
| A. | 100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+数目 | |
| B. | 常温下pH=4的KHSO4溶液和CH3COOK溶液中由水电离出的OH-离子浓度 | |
| C. | 纯水在100℃时的pH和25℃时的pH | |
| D. | 100mL 0.01mol/L的CH3COOH溶液与10mL 0.1mol/L的CH3COOH溶液的H+浓度 |
| A. | 酸性高猛酸钾 | B. | NaOH | C. | 氯气 | D. | 浓硫酸 |
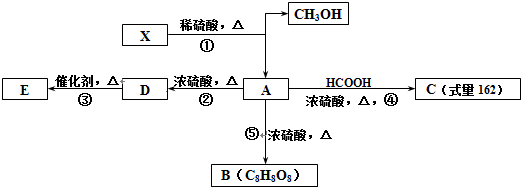
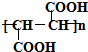
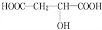 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$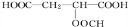 +H2O
+H2O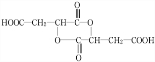
 、C和E形成的化合物
、C和E形成的化合物 、A、B和E形成的化合物
、A、B和E形成的化合物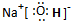 .
.