题目内容
3.钢铁的生产和使用是人类文明和生活进步的一个重要标志.(1)金属制品中镀锡铁皮(马口铁)和镀锌铁皮(白铁皮)镀层部分破损后,在潮湿的环境中,马口铁(填“马口铁”或“白铁皮”)更易腐蚀.
(2)人类重用氧化铁进行铝热反应来焊接钢轨,写出该铝热反应的化学方程式:2Al+Fe2O3高温_2Fe+Al2O3.
分析 (1)Sn、Fe和水构成原电池,发生吸氧腐蚀,Fe活动性大于Sn,所以Fe作负极、Sn作正极;Zn、Fe和水构成原电池,Zn易失电子作负极、Fe作正极,原电池中作负极的金属被腐蚀,作正极的金属被保护;
(2)铝热反应是金属铝和铁的氧化物高温反应生成熔融铁和氧化铝,据此书写方程式.
解答 解:(1)Sn、Fe和水构成原电池,发生吸氧腐蚀,Fe活动性大于Sn,所以Fe作负极、Sn作正极;Zn、Fe和水构成原电池,Zn易失电子作负极、Fe作正极,原电池中作负极的金属被腐蚀,作正极的金属被保护,所以马口铁中Fe被腐蚀、白铁皮中Fe被保护,则马口铁被腐蚀程度大于白铁皮,
故答案为:马口铁;
(2)野外焊接钢轨的铝热反应,铝和铁的氧化物高温反应生成熔融铁和氧化铝,反应的化学方程式为2Al+Fe2O3高温_2Fe+Al2O3,
故答案为:2Al+Fe2O3高温_2Fe+Al2O3.
点评 本题考查学生金属的腐蚀和防护以及铝热反应的原理知识,属于基本知识的考查,难度中等.

练习册系列答案
相关题目
13.下列有关有机物结构说法不正确的是( )
| A. | 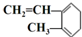 与Br2发生1:1加成反应的产物有5种 与Br2发生1:1加成反应的产物有5种 | |
| B. | 咖啡鞣酸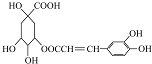 在酸性条件下水解,产物均为手性分子 在酸性条件下水解,产物均为手性分子 | |
| C. | 乙醛和丙烯醛(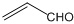 )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| D. | 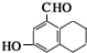 分子中所有原子不可能在同一平面上 分子中所有原子不可能在同一平面上 |
14.下列叙述中正确的是( )
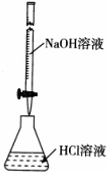

| A. | 根据图,若滴定前仰视读数,滴定终点时俯视读数,则测定的盐酸浓度偏高 | |
| B. | 250℃时,难溶物XY和AB3的KSP分别为1.0×10-10和2.7×10-15,则饱和溶液中c(X+)一定大于c(A 3+ ) | |
| C. | 每个Fe(OH)3胶体粒子含一个氢氧化铁分子 | |
| D. | 某溶液中存在K+?HCO3-?CO32-?OH-?H+,其离子浓度大小顺序可能为c(K+)>c(HCO-3)>c(H+)>c(CO2-3) |
11.价电子排布为5s25p1的元素,在周期表中的位置是( )
| A. | 第4周期第VA族 | B. | 第5周期第IIIA族 | C. | 第5周期第Ⅳ族 | D. | 第4周期第IIIA族 |
18.X、Y、Z都是短周期元素,X原子的最外层只有l个电子,Y原子的M层电子数只有K层与L层电子数之和的一半,Z原子的L层电子数比Y原子的L层电子数少2,且Y元素可有2种正价,两种正价的差值为2.由X、Y、Z三种元索组成的化合物的化学式可能是( )
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4.
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4.
| A. | ①②③ | B. | ④⑤⑥ | C. | ②⑤⑥ | D. | ①③⑤ |
8.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)④元素与⑦元素形成化合物的化学式MgCl2.
(4)①、②、⑥、⑦四种元素的最高价氧化物对应水化物中酸性最弱的是H2CO3 (填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)④元素与⑦元素形成化合物的化学式MgCl2.
(4)①、②、⑥、⑦四种元素的最高价氧化物对应水化物中酸性最弱的是H2CO3 (填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
12.下表列出了A-R 9种元素在周期表中的位置:
(1)这9种元素分别为(写元素符号)ANa、BK、CMg、DAl、EC、FO、GCl、HBr、RAr,其中化学性质最不活泼的是Ar;
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程 .
.
(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
13.元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度.下表为部分短周期元素的电负性.请回答下列问题.
(1)根据上表给出的数据,可知元素的电负性越大,非金属性(填“金属性”或“非金属性”)越强.
(2)推测Y 为Na(填元素符号),用电子式表示Y元素与氧元素、氢元素形成化合物的电子式: 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.
(3)写出Y的最高价氧化物水化物与Al反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.该反应的还原剂是Al(填化学式).
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(2)推测Y 为Na(填元素符号),用电子式表示Y元素与氧元素、氢元素形成化合物的电子式:
 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.(3)写出Y的最高价氧化物水化物与Al反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.该反应的还原剂是Al(填化学式).