题目内容
8.下表是元素周期表的一部分,请回答有关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)④元素与⑦元素形成化合物的化学式MgCl2.
(4)①、②、⑥、⑦四种元素的最高价氧化物对应水化物中酸性最弱的是H2CO3 (填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
分析 由元素在元素周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)稀有气体Ar最外层为稳定结构,化学性质最不活泼,原子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)氢氧化铝是两性氢氧化物,Al与氢氧化钾反应生成偏铝酸钾与氢气;
(3)④元素与⑦元素形成化合物为氯化镁;
(4)非金属性越强,最高价含氧酸的酸性越强;
(5)由周期性可知,③元素与⑩元素两者核电荷数之差为第二周期、第四周周期容纳的元素种数之和.
解答 解:由元素在元素周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)稀有气体Ar最外层为稳定结构,化学性质最不活泼,原子核外有18个电子,有3个电子层,各层电子数为2、8、8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)Al元素形成氢氧化物--氢氧化铝是两性氢氧化物,Al与氢氧化钾反应生成偏铝酸钾与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)④元素与⑦元素形成化合物为MgCl2,故答案为:MgCl2;
(4)①、②、⑥、⑦四种元素的最高价氧化物对应水化物分别为H2CO3、HNO3、H2SO4、HClO4,其中C元素非金属最弱,酸性最弱,属于燃烧,其它三种属于强酸,故答案为:H2CO3;
(5)由周期性可知,③元素与⑩元素两者核电荷数之差为第二周期、第四周周期容纳的元素种数之和,即二者核电荷数之差为8+18-26,故答案为:26.
点评 本题考查元素周期表与元素周期律、常用化学用语等,属于基础知识的考查,注意理解同主族元素原子序数之间故选,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 原子的原子序数越大,原子半径越大 | |
| B. | 同族元素相差的原子序数可能为16、26、36、46 | |
| C. | I A族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 碱金属单质的熔点、沸点均随着原子序数的递增而升高 |
| A. | HX>HZ>HY | B. | HZ>HY>HZ | C. | HX>HY>HZ | D. | HY>HZ>HX |
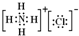 .下列有关氯化铵的叙述中,正确的是( )
.下列有关氯化铵的叙述中,正确的是( )| A. | 属于离子化合物 | B. | 属于共价化合物 | C. | 只含有离子键 | D. | 只含有共价键 |
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Mg2+、NH4+、SO42-、K+ | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Ca2+、HCO3-、NH4+、AlO2- |
 有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为
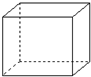
有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为  .“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图:
.“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图: B.
B. 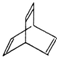 C.
C.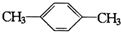 D.
D.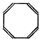
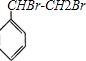 .
.