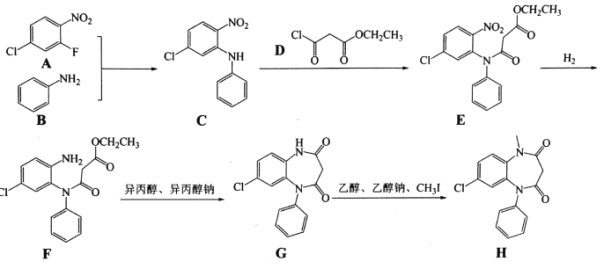
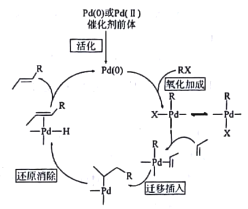
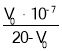题目内容
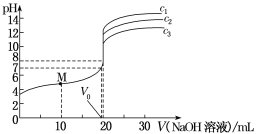
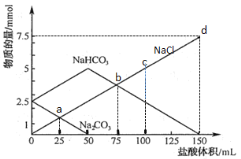
【题目】25℃时,向10.00mL0.1000mol·L-1H2SO4溶液中滴加相同物质的量浓度的氨水,测得混合溶液中-lgc(OH-)随滴加氨水体积的变化如图所示,下列说法错误的是
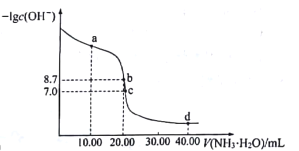
A.水的电离程度:b>c>a
B.Kh(NH4+)的数量级为10-10
C.c点满足c(SO42-)>c(NH4+)>c(H+)=c(OH-)
D.d点满足c(NH4+)+2c(H+)=c(NH3H2O)+2c(OH-)
【答案】C
【解析】
A. 原溶液为硫酸溶液,对水的电离起抑制作用,在滴加氨水的过程中,酸性逐渐减弱,水的电离程度增大,在恰好完全中和即在加入 ![]() ,
,![]() 时,此时只存在
时,此时只存在 ![]() 的水解过程,水的电离程度最大,而后再滴入
的水解过程,水的电离程度最大,而后再滴入 ![]() ,相当于加入了碱对水的电离起抑制作用,电离程度又减小,由分析可知
,相当于加入了碱对水的电离起抑制作用,电离程度又减小,由分析可知 ![]() 点水的电离程度最大,其次
点水的电离程度最大,其次 ![]() 、
、![]() 之间
之间 ![]() ,故A正确;
,故A正确;
B. ![]() 的水解方程式为:
的水解方程式为:![]() ,
,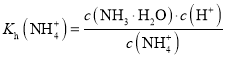 ,要计算
,要计算 ![]() 则需要在图中找到特殊点,能得知等式中的三个量,如
则需要在图中找到特殊点,能得知等式中的三个量,如 ![]() 点,因为
点,因为 ![]() 点是恰好完全反应的点,根据横纵坐标能得知方程式中各微粒的量,由纵坐标
点是恰好完全反应的点,根据横纵坐标能得知方程式中各微粒的量,由纵坐标 ![]() 可得
可得 ![]() ,则
,则 ![]() 也等于
也等于 ![]() ,
,![]() 由于恰好完全反应,且水解程度微弱,可做近似计算,
由于恰好完全反应,且水解程度微弱,可做近似计算,![]() ,代入
,代入 ![]() 表达式,可得
表达式,可得 ![]() ,故B正确;
,故B正确;
C. 根据电荷守恒:![]() ,
,![]() 点
点 ![]() ,此时
,此时 ![]() ,则
,则 ![]() ,即
,即 ![]() ,故C错误;
,故C错误;
D. ![]() 点加入
点加入 ![]() ,此时溶液中溶质成分为:
,此时溶液中溶质成分为:![]() ,由电荷守恒
,由电荷守恒 ![]() ,和物料守恒
,和物料守恒 ![]() ,联立可得质子守恒
,联立可得质子守恒 ![]() ,故D正确;
,故D正确;
故答案选C。

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目