题目内容
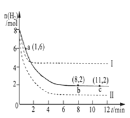
【题目】Ⅰ下图为几种晶体或晶胞的示意图:
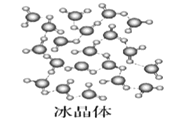
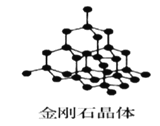
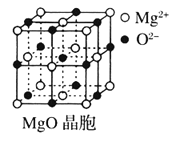
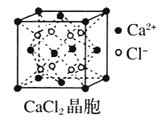
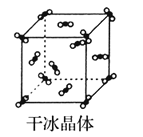
请回答下列问题:
(1)上述晶体中,粒子之间仅以共价键结合形成的晶体是____________。
(2)冰、金刚石、![]() 、
、![]() 、干冰5种晶体的熔点由高到低的顺序为_________________。
、干冰5种晶体的熔点由高到低的顺序为_________________。
(3)![]() 晶胞与
晶胞与![]() 晶胞相同,
晶胞相同,![]() 晶体的晶格能______(填“大于”或“小于”)
晶体的晶格能______(填“大于”或“小于”)![]() 晶体,原因是_________________。
晶体,原因是_________________。
(4)![]() 晶体中
晶体中![]() 的配位数为____________。
的配位数为____________。
(5)冰的熔点远高于干冰,除![]() 是极性分子、
是极性分子、![]() 是非极性分子外,还有一个重要的原因是__________________。
是非极性分子外,还有一个重要的原因是__________________。
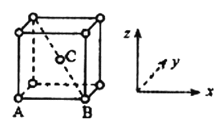
Ⅱ(1)原子坐标参数可表示晶胞内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数![]() 、
、![]() ,则
,则![]() 原子的坐标参数为________________。
原子的坐标参数为________________。
(2)钾晶体的晶胞参数为![]() 。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____
。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____![]() ,晶体钾的密度计算式是_____
,晶体钾的密度计算式是_____![]() 。
。
【答案】金刚石晶体 金刚石>![]() >
>![]() >冰>干冰 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数,且r(Mg2+)<r(Na+)r(O2-)<r(Cl-) 8 水分子间形成分子间氢键
>冰>干冰 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数,且r(Mg2+)<r(Na+)r(O2-)<r(Cl-) 8 水分子间形成分子间氢键 ![]()
![]()
![]()
【解析】
分子晶体的分子之间有范德华力及氢键,离子晶体之间是离子键,金属晶体之间是金属键,原子晶体微粒之间是共价键;熔点的一般规律:原子晶体>离子晶体>分子晶体,分子间能形成氢键时,沸点反常的高;根据晶胞具体构型计算相关问题。
Ⅰ(1)原子晶体中原子间以共价键结合,则粒子之间以共价键结合形成的晶体是金刚石晶体;(2)熔点的一般规律:原子晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石、MgO、CaCl2、冰、干冰;
(3)因为MgO中离子带两个电荷,NaCl中离子带一个电荷,氧离子半径小于氯离子,根据离子半径越小,离子带电荷越多,晶格能越大,可得MgO晶体的晶格能大于NaCl晶体的晶格能;
(4)根据![]() 晶胞观察,可知一个
晶胞观察,可知一个![]() 可与8个Cl-相连,故晶体中
可与8个Cl-相连,故晶体中![]() 的配位数为8;
的配位数为8;
(5)冰的熔点远高于干冰,除![]() 是极性分子、
是极性分子、![]() 是非极性分子外,水分子间能形成分子间氢键,增大物质的熔沸点;
是非极性分子外,水分子间能形成分子间氢键,增大物质的熔沸点;
Ⅱ(1)金属钾是体心立方晶系,根据构型可知,![]() 点位于晶体的体心,则
点位于晶体的体心,则![]() 原子的坐标参数:
原子的坐标参数:![]() ;
;
(2)钾晶体的晶胞参数为![]() ,假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则
,假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则![]() ,钾原子的半径为
,钾原子的半径为![]()
![]() ,计算晶体钾的密度:
,计算晶体钾的密度:![]()
![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D