题目内容
17.下列描述,其因果关系成立的是( )| A. | 因为酸性HF>HCl,所以非金属性F>Cl | |
| B. | 因为SO2、Cl2都有漂白性,所以二者混合使用漂白有色物质,效果会更好 | |
| C. | 因为某物质的焰色反应呈黄色,所以其一定是含Na元素的化合物 | |
| D. | 因为烯烃的通式为CnH2n,不同烯烃的实验式相同,所以烯烃的含碳量为一常数 |
分析 A.不能根据氢化物酸性判断非金属性;
B.二氧化硫具有还原性,能和氯气发生氧化还原反应;
C.焰色反应为元素的性质;
D.根据烯烃的最简式判断.
解答 解:A.不能根据氢化物酸性判断非金属性,如非金属性F>Cl,但HF是弱酸,HCl是强酸,应比较最高价氧化物的水化物的酸性强弱,酸性越强,非金属性越强,故A错误;
B.二氧化硫具有还原性,氯气具有氧化性,在水溶液里,氯气和二氧化硫、水反应生成硫酸和盐酸而失去漂白性,故B错误;
C.焰色反应为元素的性质,含Na元素的化合物和钠单质的焰色反应均为黄色,故C错误;
D.烯烃的通式为CnH2n,不同烯烃的实验式相同为CH2,所以烯烃的含碳量为一常数,即为$\frac{6}{7}$,故D正确.
故选D.
点评 本题考查了物质的性质及用途、非金属性的比较等,明确物质的性质决定其用途是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.关于含正离子N5+的化合物N5AsF6,下列叙述中错误的是( )
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以离子键结合 | ||
| C. | 化合物N5AsF6中AS的化合价为+5价 | D. | 化合物N5AsF6为离子化合物 |
9.已知2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.在25℃时,向恒压密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量a1 kJ;若25℃时在此恒压密闭容器中只通入1mol SO2和0.5mol O2,达到平衡时放出热量a2 kJ.则下列关系正确的是( )
| A. | 2a2=a1=197 | B. | 197>a1=2a2 | C. | a2>a1>197 | D. | 2a2<a1<197 |
6.下列叙述正确的是( )
| A. | 某有机物分子中无支链,其名称为“乙×”,则该有机物的一个分子中一定含两个碳原子 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可以计算某些难于直接测量的反应的反应热 | |
| D. | △H小于零的反应是放热反应,这类反应的平衡常数K一般都大于1 |
7.香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法不正确的是( )
| A. | 原子半径:Y>Z>R>T | |
| B. | 气态氢化物的稳定性:W<R<T | |
| C. | 最高价氧化物对应的水化物碱性:X>Y>Z | |
| D. | XR2、WR2两化合物中R的化合价相同 |
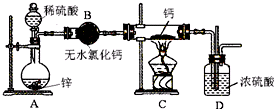
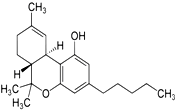 2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF
2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”.如图是大麻的主要成分THC的结构式.下列关于THC的说法中正确的是BEF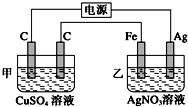 用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.
用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加.