题目内容
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为_________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是_____________(填序号)。
a.Ba(OH)2溶液 b.BaCl2溶液 c.NaOH溶液 d.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____________(填“高于”、“低于”或“等于”)8.3,则甲判断正确。
(4)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离出的OH-浓度分别为a mol/L和b mol/L。则a:b=________。
(5)25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液。
①下列判断不正确的是________(填序号)。
a.两种溶液等体积混合后:3c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)]
b.两种溶液中存在的粒子种类不相同
c.两种溶液中c(H+)·c(OH-)=10-14
d.两种溶液中分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大
②等体积混合后溶液中离子浓度由大到小的顺序是:__________;
③常温下,等体积混合后的溶液中滴加稀盐酸至中性时,溶质的主要成分有:_______。
【答案】HCO3-+H2O![]() H2CO3+OH- 大于 乙 b 等于 10-4:1 ab c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) NaCl、NaHCO3、CO2(H2CO3)
H2CO3+OH- 大于 乙 b 等于 10-4:1 ab c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) NaCl、NaHCO3、CO2(H2CO3)
【解析】
碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性;碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度;NaHCO3和BaCl2不反应,但Na2CO3和BaCl2能反应生成白色沉淀BaCO3:Na2CO3+BaCl2=BaCO3↓+2NaCl,向Na2CO3或NaHCO3溶液中加入Ba(OH)2或氢氧化钙都生成白色沉淀BaCO3,向Na2CO3(不反应)溶液或NaHCO3(要反应)溶液中加入NaOH都不产生明显现象;在测得PH都等于9的NaOH溶液和Na2CO3溶液中,NaOH溶液由水电离的OH-浓度为a=10-9mol/L,Na2CO3溶液由水电离的OH-浓度为b=10-5mol/L;25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液两种溶液等体积混合后,存在物料守恒: 2c(Na+)=3 [c(HCO3-)+c(CO32-)+c(H2CO3)];NaHCO3和Na2CO3溶液中存在的微粒均为:碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同;温度不变,水的离子积常数不变;分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大;等体积混合后溶液显碱性,CO32-与HCO3-水解程度大于电离程度,CO32-水解会产生HCO3-;常温下,等体积混合后的溶液中滴加稀盐酸,NaCl显中性,H2CO3显酸性,NaHCO3显碱性。
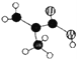
(1)碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,水解方程式为HCO3-+H2OH2CO3+OH-;
故答案为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(2) 碳酸钠是强碱弱酸盐能水解,碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度;
故答案为:大于;
(3) ①NaHCO3和BaCl2不反应,但Na2CO3和BaCl2能反应生成白色沉淀BaCO3:Na2CO3+BaCl2=BaCO3↓+2NaCl,向Na2CO3或NaHCO3溶液中加入Ba(OH)2或氢氧化钙都生成白色沉淀BaCO3,向Na2CO3(不反应)溶液或NaHCO3(要反应)溶液中加入NaOH都不产生明显现象,②若加热后NaHCO3不分解,溶液仍然是NaHCO3溶液,温度不变溶液的PH值也不变,由此证明甲是正确的;
故答案为:乙;b;等于;
(4) 在测得PH都等于9的NaOH溶液和Na2CO3溶液中,NaOH溶液由水电离的OH-浓度为a=10-9mol/L,Na2CO3溶液由水电离的OH-浓度为b=10-5mol/L,则a:b=10-4:1;
故答案为:10-4:1;
(5) ①a.25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液两种溶液等体积混合后,存在物料守恒: 2c(Na+)=3 [c(HCO3-)+c(CO32-)+c(H2CO3)],故a错误;
b.NaHCO3和Na2CO3溶液中存在的微粒均为:碳酸根、碳酸氢根、氢氧根、氢离子、碳酸分子、水分子,存在的粒子种类相同,故b错误;
c.温度不变,水的离子积常数不变,故c正确;
d.分别加入NaOH固体,恢复到原温度,碳酸氢根和氢氧根在溶液反应会生成碳酸根和水,氢氧根对它们的水解均起到抑制作用,所以c(CO32-)均增大,故d正确;
故答案选ab;
②等体积混合后溶液显碱性,CO32-与HCO3
③常温下,等体积混合后的溶液中滴加稀盐酸,在此过程中,HCO3-与H+生成水和CO2,CO32-与H+生成HCO3-、H2CO3,阴离子与Na+生成NaCl、NaHCO3,NaCl显中性,H2CO3显酸性,NaHCO3显碱性,故至中性时,溶质的主要成分有:NaCl、NaHCO3、CO2(H2CO3);
故答案为:ab;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);NaCl、NaHCO3、CO2(H2CO3)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案