��Ŀ����
����Ŀ�����·�ZnS��BaSO4��Ҳ��п���ף�����һ�ֳ��ð�ɫ���ϡ��ش��������⣺
��1��������ɫ��Ӧ��ԭ���ȿ���������ͷĽ����̻�����ɶ��Լ���ijЩ�����Ρ��������·���Ʒʱ��������ɫΪ__________�����ţ���
A����ɫ B����ɫ C����ɫ D����ɫ
��2�����ؾ�ʯ��BaSO4��Ϊԭ�ϣ��ɰ����¹����������·ۣ�
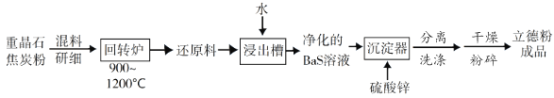
���ڻ�ת¯���ؾ�ʯ��������̿��ԭΪ�����������ù��̵Ļ�ѧ����ʽΪ______________________����ת¯β���к����ж����壬�����Ͽ�ͨ��ˮ�����任��Ӧ����ת��ΪCO2��һ�������Դ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________��
���ڳ�ʪ�����г��ڷ��õ�����ԭ���������ݳ���������ζ�����壬��ˮ���Ա���ԭ��������ԭ��������������������ˮ��___________���ѧʽ����
�۳������з�Ӧ�����ӷ���ʽΪ______________________��
��3����Ʒ��S2�ĺ���������������������á���ȡm g��Ʒ�����ڵ���ƿ�У���ȡ25.00 mL 0.1000 mol��L1��I2KI��Һ�����У�������������Һ���ܱգ��ð�����Ӧ5 min���е������������Ե�����ҺΪָʾ����������I2��0.1000 mol��L1Na2S2O3��Һ�ζ�����ӦʽΪI2+2![]() =2I+
=2I+![]() ���ⶨʱ����Na2S2O3��Һ���V mL���յ���ɫ�仯Ϊ_________________����Ʒ��S2�ĺ���Ϊ______________��д������ʽ����
���ⶨʱ����Na2S2O3��Һ���V mL���յ���ɫ�仯Ϊ_________________����Ʒ��S2�ĺ���Ϊ______________��д������ʽ����
���𰸡�D BaSO4+4C![]() BaS+4CO�� CO+H2O
BaS+4CO�� CO+H2O![]() CO2+H2 BaCO3 S2+Ba2++Zn2++
CO2+H2 BaCO3 S2+Ba2++Zn2++![]()
![]() BaS��BaSO4�� dz��ɫ����ɫ
BaS��BaSO4�� dz��ɫ����ɫ 
��������
��1����ɫ��Ӧ�����ڻ�ѧ�仯���������������Ԫ�ش��ڣ���������Ԫ����ɫ��
��Na����ɫ�� ���Li���Ϻ죩����K��dz�ϣ����Rb����ɫ������Ca��ש��ɫ������Sr����죩��ͭCu����ɫ������Ba�����̣����Cs���Ϻ죩��
��2�������ؾ�ʯ�뽹̿�ڻ�ת¯�з�ӦBaSO4+4C=BaS+4CO�������ɻ�ԭ��BaS������Һ������п�������ֽⷴӦS2-+Ba2++Zn2++SO42-=BaSO4+ZnS�����õ����·ۡ�
��ע�⽹̿��������CO����Ӧ��Ϊ���ᱵ�뽹̿������ΪBaS��CO��д������ʽ��CO��ˮ������Ӧ����CO2��H2��д������ʽCO+H2O=CO2+H2��
�ڸ�����Ϣ��������ζ����Ϊ�������壬��ǿ��������ԭ������ԭ�����������ˮ��������̼��Ӧ������̼�ᱵ���������壻
����������пΪ������ǿ����ʣ�д��������ʽ���������ᱵ����пΪ���������ɵ��룬д�����ӷ���ʽ��
��3���ⵥ������ۻ��Ϊ��ɫ������������Ƶζ�������I2�����յ���ɫ�仯Ϊdz��ɫ����ɫ������������ԭ��Ӧ��ʧ��������ȣ����ù�ϵʽ�����⣻
��1����ɫ��Ӧ���ǻ�ѧ�仯���������������Ԫ�ش��ڣ���������Ԫ����ɫ��
A.�Ƶ���ɫΪ��ɫ����A����
B.�Ƶ���ɫΪ��ɫ����B����
C.�ص���ɫΪ��ɫ����C����
D.������ɫΪ��ɫ����D��ȷ��
�𰸣�D��
��2����ע�⽹̿��������CO����Ӧ��Ϊ���ᱵ�뽹̿������ΪBaS��CO��д������ʽBaSO4+4C=BaS+4CO����CO��ˮ������Ӧ����CO2��H2��д������ʽ��CO+H2O=CO2+H2��
�𰸣�BaSO4+4C=BaS+4CO����CO+H2O=CO2+H2��
�ڸ�����Ϣ��������ζ����Ϊ�������壬��ǿ��������ԭ������ԭ�����������ˮ��������̼��Ӧ������̼�ᱵ���������壻
�𰸣�BaCO3��
����������пΪ������ǿ����ʣ�д��������ʽ���������ᱵ����пΪ���������ɵ��룬д�����ӷ���ʽ��S2-+Ba2++Zn2++SO42-=BaSO4+ZnS����
�𰸣�S2-+Ba2++Zn2++SO42-=BaSO4+ZnS����
��3���ⵥ���������ӵķ�Ӧ��S2-+I2=S+2I-���ⵥ������ۻ��Ϊ��ɫ������������Ƶζ�������I2�����յ���ɫ�仯Ϊdz��ɫ����ɫ������������ԭ��Ӧ��ʧ��������ȣ����ù�ϵʽ�����⣻���ݻ��ϼ���������й�ϵʽ�������������ʵ���Ϊnmol��
S2- �� I2 2S2O32- �� I2
1mol 1mol 2mol 1mol
n mol nmol 0.1V��10-3mol![]() 0.1V��10-3mol
0.1V��10-3mol
n+![]() 0.1V��10-3mol=25
0.1V��10-3mol=25![]() 0.1V��10-3mol����n=��25-
0.1V��10-3mol����n=��25-![]() V��0.1��10-3mol
V��0.1��10-3mol
����Ʒ�������Ӻ���Ϊ��![]() ��100%=
��100%=  ��100%
��100%
�𰸣�dz��ɫ����ɫ�� ��100%��
��100%��

����Ŀ��10��ʱ����NaHCO3������Һ����ø���Һ��pH�������±仯
�¶�(��) | 10 | 20 | 30 | ������к���ȴ��50�� |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)��ͬѧ��Ϊ������Һ��pHֵ���ߵ�ԭ����HCO3����ˮ��̶����ʼ�����ǿ���÷�Ӧ�����ӷ���ʽΪ_________��
(2)��ͬѧ��Ϊ����ҺpH���ߵ�ԭ����NaHCO3���ȷֽ⣬������Na2CO3�����ƶ�Na2CO3��ˮ��̶�_________(��������������С����)NaHCO3��
(3)��ͬѧ��Ϊ�ס��ҵ��ж϶�����֡�����Ϊ��
��ֻҪ�ڼ�����е���Һ�м����������Լ�X����������������_________(����������������)�ж���ȷ���Լ�X��_____________(�����)��
a.Ba(OH)2��Һ b.BaCl2��Һ c.NaOH��Һ d.����ʯ��ˮ
�ڽ����Ⱥ����Һ��ȴ��10�棬����Һ��pH____________(������������������������������)8.3������ж���ȷ��
(4)�����£��ڲ��pH������9��NaOH��Һ��Na2CO3��Һ�У���ˮ�������OH��Ũ�ȷֱ�Ϊa mol/L��b mol/L����a��b��________��
(5)25��ʱ��Ũ�Ⱦ�Ϊ0.1 mol/L��Na2CO3��NaHCO3��Һ��
�������жϲ���ȷ����________(�����)��
a.������Һ�������Ϻ�3c(Na��)��2[c(HCO3��)��c(CO32��)��c(H2CO3)]
b.������Һ�д��ڵ����������ͬ
c.������Һ��c(H��)��c(OH��)��10��14
d.������Һ�зֱ��������NaOH���壬�ָ���ԭ�¶ȣ�c(CO32��)������
�ڵ������Ϻ���Һ������Ũ���ɴ�С��˳���ǣ�__________��
�۳����£��������Ϻ����Һ�еμ�ϡ����������ʱ�����ʵ���Ҫ�ɷ��У�_______��
����Ŀ�����и������ʣ����ܰ���ͼ(��������ʾ��Ӧһ�����)��ϵת������

ѡ���� | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
����Ŀ������������ʵ�����������õ���ƽ�ⳣ����ʾ����1�dz����¼�������ĵ���ƽ�ⳣ��(Ka)������ĵ���ƽ�ⳣ��(Kb)����2�dz����¼����ѣ���������ܶȻ�����(Ksp)��
��1
���� | ����ƽ�ⳣ����Ka��Kb�� |
CH3COOH | 1.8��10��5 |
HNO2 | 4.6��10��4 |
HCN | 5��10��10 |
HClO | 3��10��8 |
NH3H2O | 1.8��10��5 |
��2
�ѣ������� | �ܶȻ�������Ksp�� |
BaSO4 | 1��10��10 |
BaCO3 | 2.6��10��9 |
CaSO4 | 7��10��5 |
CaCO3 | 5��10��9 |
��ش��������⣺
��1����1�������������У�������������_____���û�ѧʽ��ʾ����������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ�����___������ĸ��ţ���
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ��_____��ѡ����ԡ��������ԡ����ԡ���������Һ�д��ڵĸ�����Ũ�ȴ�С��ϵΪ_____��
��3�����ʵ���֮��Ϊ1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ������Ũ�ȴӴ�С��˳��Ϊ_____��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɿ����Եı��Σ���BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3����������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42�����ʵ���Ũ�Ȳ�С��0.01molL��1������Һ��CO32�����ʵ���Ũ������ӦΪ_____��


