题目内容
【题目】用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________种。
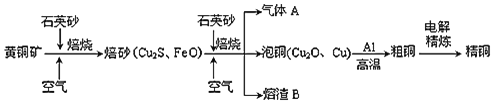
(2)某有机物含C、H、O三种元素,分子模型如图所示 (图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_______,所含官能团的名称为 __________。
(3)常温下,已知0.1 mol·L-1一元酸HA溶液中![]() =1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;写出该酸(HA)与NaOH溶液反应的离子方程式: _______________________________。
(4)25℃时,已知Ksp[Fe(OH)3]=8×10-38,则0.01mol/L FeCl3溶液中欲使Fe3+沉淀,求溶液所需的最小pH=________。(用对数形式表示)
【答案】4种 CH2=C(CH3)COOH 碳碳双键和羧基 3 HA + OH- =A- + H2O 2+lg2
【解析】
(1)C4H10为烷烃,有正丁烷和异丁烷2种同分异构体,正丁烷的一氯代物有2种,异丁烷的一氯代物有2种,则C4H10的一氯代物有4种,故答案为:4;
(2)由分子模型可知,白球是氢原子,黑球是碳原子,半黑球是氧原子,则该有机物的结构简式为CH2=C(CH3)COOH,官能团为碳碳双键和羧基,故答案为:CH2=C(CH3)COOH;碳碳双键和羧基;
(3)由常温下,0.1 mol·L-1一元酸HA溶液中![]() =1×10-8可知溶液中c(OH—)=10—8c(H+),c(H+)=
=1×10-8可知溶液中c(OH—)=10—8c(H+),c(H+)=![]() mol/L=1×10—3mol/L,溶液的pH为3,则HA为弱酸,HA与NaOH溶液反应生成NaA和水,反应的离子方程式为HA + OH- =A- + H2O,故答案为,3;HA + OH- =A- + H2O;
mol/L=1×10—3mol/L,溶液的pH为3,则HA为弱酸,HA与NaOH溶液反应生成NaA和水,反应的离子方程式为HA + OH- =A- + H2O,故答案为,3;HA + OH- =A- + H2O;
(4)由Ksp[Fe(OH)3]=8×10-38可知0.01mol/L FeCl3溶液中欲使Fe3+沉淀时,溶液中c(OH—)=![]() mol/L=2×10—12mol/L,则溶液的pH为(14—12+lg2)=2+lg2,故答案为:2+lg2。
mol/L=2×10—12mol/L,则溶液的pH为(14—12+lg2)=2+lg2,故答案为:2+lg2。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为_________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是_____________(填序号)。
a.Ba(OH)2溶液 b.BaCl2溶液 c.NaOH溶液 d.澄清石灰水
②将加热后的溶液冷却到10℃,若溶液的pH____________(填“高于”、“低于”或“等于”)8.3,则甲判断正确。
(4)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离出的OH-浓度分别为a mol/L和b mol/L。则a:b=________。
(5)25℃时,浓度均为0.1 mol/L的Na2CO3和NaHCO3溶液。
①下列判断不正确的是________(填序号)。
a.两种溶液等体积混合后:3c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)]
b.两种溶液中存在的粒子种类不相同
c.两种溶液中c(H+)·c(OH-)=10-14
d.两种溶液中分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大
②等体积混合后溶液中离子浓度由大到小的顺序是:__________;
③常温下,等体积混合后的溶液中滴加稀盐酸至中性时,溶质的主要成分有:_______。
【题目】某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。
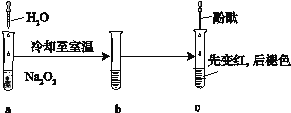
(1)Na2O2中含有的化学键类型:__________;请写出a中反应的化学方程式______。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2+ H2O =" NaOH" + H2O22H2O2= 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中,____________,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
①_____________________;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
实验 | 操作 | 现象 | 结论 |
1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①___________ |
2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |
|
3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12…… | ②_____________________________…… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(5)某同学按取(4)中述实验2褪色后的溶液,加水稀释至pH=12,没有观察到溶液变红。该同学推测实验2加盐酸后溶液变红还可能与温度有关,请写出理由:___________。
【题目】描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10﹣5 |
HNO2 | 4.6×10﹣4 |
HCN | 5×10﹣10 |
HClO | 3×10﹣8 |
NH3H2O | 1.8×10﹣5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10﹣10 |
BaCO3 | 2.6×10﹣9 |
CaSO4 | 7×10﹣5 |
CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01molL﹣1,则溶液中CO32-物质的量浓度最少应为_____。