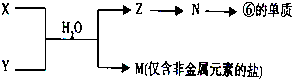
题目内容
表是元素周期表的一部分,回答下列有关问题:
(1)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)______,碱性最强的是______,呈两性的氢氧化物是______,
(2)写出工业上冶炼⑤的化学方程式为______;⑤与一种黑色晶体反应冶炼铁的化学方程式为:______.
(3)在⑧与⑦中,非金属性较强的元素是______,写出可以验证该结论的一个离子反应方程式______.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | 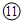 |  |
(2)写出工业上冶炼⑤的化学方程式为______;⑤与一种黑色晶体反应冶炼铁的化学方程式为:______.
(3)在⑧与⑦中,非金属性较强的元素是______,写出可以验证该结论的一个离子反应方程式______.
由元素在周期表的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K, 为Ca,
为Ca, 为Br,
为Br,
(1)最高价氧化物对应水化物中,Cl的最高价氧化物的水化物酸性最强,该酸为HClO4,K的最高价氧化物的水化物碱性最强,该碱为KOH,氢氧化铝为两性氢氧化物,该两性氢氧化物为Al(OH)3,故答案为:HClO4;KOH;Al(OH)3;
(2)电解法冶炼Al,该反应为2Al2O3(熔融)
4Al+3O2↑;Al与四氧化三铁反应生成Fe,该反应为3Fe3O4+8Al
9Fe+4Al2O3,
故答案为:2Al2O3(熔融)
4Al+3O2↑;3Fe3O4+8Al
9Fe+4Al2O3;
(3)Cl、S位于同周期,原子序数大的非金属性强,非金属性Cl>S,可利用非金属单质之间的置换反应说明,如Cl2+S2-=S↓+2Cl-,故答案为:Cl;Cl2+S2-=S↓+2Cl-.
 为Ca,
为Ca, 为Br,
为Br,(1)最高价氧化物对应水化物中,Cl的最高价氧化物的水化物酸性最强,该酸为HClO4,K的最高价氧化物的水化物碱性最强,该碱为KOH,氢氧化铝为两性氢氧化物,该两性氢氧化物为Al(OH)3,故答案为:HClO4;KOH;Al(OH)3;
(2)电解法冶炼Al,该反应为2Al2O3(熔融)
| ||
| 冰晶石 |
| ||
故答案为:2Al2O3(熔融)
| ||
| 冰晶石 |
| ||
(3)Cl、S位于同周期,原子序数大的非金属性强,非金属性Cl>S,可利用非金属单质之间的置换反应说明,如Cl2+S2-=S↓+2Cl-,故答案为:Cl;Cl2+S2-=S↓+2Cl-.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目