题目内容
下列元素中,不属于主族元素的是( )
| A.铜 | B.钙 | C.磷 | D.碘 |
A.Cu的外围电子排布为3d104s1,处于ds区,ⅠB族,故A选;
B.Ca的外围电子排布为4s2,处于s区,ⅡA族,故B不选;
C.P的外围电子排布为3s23p3,处于p区,ⅤA族,故C不选;
D.I的外围电子排布为5s25p5,处于p区,ⅦA族,故C不选;
故选A.
B.Ca的外围电子排布为4s2,处于s区,ⅡA族,故B不选;
C.P的外围电子排布为3s23p3,处于p区,ⅤA族,故C不选;
D.I的外围电子排布为5s25p5,处于p区,ⅦA族,故C不选;
故选A.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
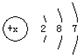 的元素
的元素 的元素
的元素