题目内容
下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为:F2+2Cl-=Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>33As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易.
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为:F2+2Cl-=Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>33As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易.
| A.①② | B.③④ | C.①④ | D.②③ |
①因为F2非常活泼能与水反应,所以F2通入NaCl溶液中,发生反应为:2F2+2H2O=O2+4HF,故错误;
②非金属性F>Br,氢化物的稳定性:HF>HBr,不能判断氢化物的酸性,故错误;
③非金属性S>33As,非金属性越强氢化物越稳定,故前者的气态氢化物稳定性更强,故正确;
④非金属性O>N,非金属性越强,与氢气反应的越容易,故O2与H2化合比N2更容易,故正确;
所以不正确的有①②;
故选A.
②非金属性F>Br,氢化物的稳定性:HF>HBr,不能判断氢化物的酸性,故错误;
③非金属性S>33As,非金属性越强氢化物越稳定,故前者的气态氢化物稳定性更强,故正确;
④非金属性O>N,非金属性越强,与氢气反应的越容易,故O2与H2化合比N2更容易,故正确;
所以不正确的有①②;
故选A.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
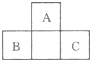
 和黑色的HD两种化合物。
和黑色的HD两种化合物。 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。 分子的空间构型为 。
分子的空间构型为 。 极易溶于
极易溶于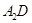 ,原因是 。
,原因是 。 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和