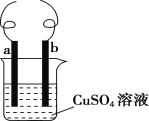
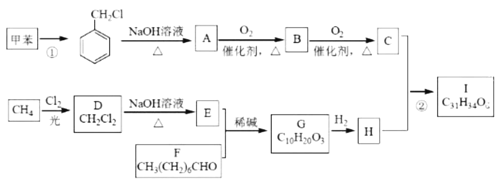
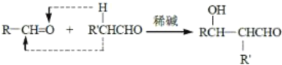
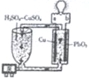
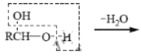题目内容
【题目】氢氧化镁:①是中强碱;②广泛用作阻燃剂和填充剂.以白云石(化学式:MgCO3CaCO3)为原料制备氢氧化镁的工艺流程如下:
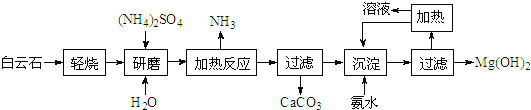
(1)根据流程图,白云石“轻烧”后固体产物的主要成份是MgO和_______(写化学式)。
(2)流程图中“加热反应”有氨气生成的化学方程式为_________________________。
(3)洗涤Mg(OH)2沉淀所用玻璃仪器有:_______、烧杯、玻棒;检验洗净的方法是____________。
(4)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是__________________。
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10﹣4mol/L,Mg(O2)22﹣、Mg(OH)42﹣的浓度共为2.35×10﹣4mol/L,则溶液的pH=_______(取整数值);若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22﹣、Mg(OH)42﹣的浓度共为1.50×10﹣4mol/L,则该工艺的产率为___________(保留4位小数)。
【答案】CaCO3 (NH4)2SO4+MgO![]() MgSO4+2NH3↑+H2O 漏斗 取洗涤液,加入氯化钡溶液,若无沉淀生成,说明已洗净 减少能源消耗或便于CaCO3分离 10 99.97%
MgSO4+2NH3↑+H2O 漏斗 取洗涤液,加入氯化钡溶液,若无沉淀生成,说明已洗净 减少能源消耗或便于CaCO3分离 10 99.97%
【解析】
流程分析白云石主要成分为MgCO3CaCO3轻烧,从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体。
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO![]() MgSO4+2NH3↑+H2O;
MgSO4+2NH3↑+H2O;
(3)洗涤氢氧化镁沉淀应在过滤器中进行,检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子;
(4)减少能源消耗、便于CaCO3分离;
(5)溶液中离子电荷守恒计算;产率=![]() ×100%。
×100%。
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,分解生成氧化镁,白云石“轻烧”后固体产物的主要成份CaCO3、MgO;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO![]() MgSO4+2NH3↑+H2O;
MgSO4+2NH3↑+H2O;
(3)洗涤氢氧化镁沉淀应在过滤器中进行,检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子,洗涤Mg(OH)2沉淀所用玻璃仪器有漏斗、烧杯、玻棒等,取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
(4)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离;
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10﹣4mol/L,Mg(O2)22﹣、Mg(OH)42﹣的浓度共为2.35×10﹣4mol/L,溶液则电荷守恒得到,2c(Mg2+)=c(OH﹣)+2c[Mg(O2)22﹣]+2c[Mg(OH)42﹣],c(OH﹣)=2×2.80×10﹣4mol/L﹣2×2.35×10﹣4mol/L=9×10﹣5,c(H+)≈10﹣10mol/L,则溶液的pH=10;若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22﹣、Mg(OH)42﹣的浓度共为1.50×10﹣4mol/L,则该工艺的产率=![]() ×100%=99.97%。
×100%=99.97%。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案