题目内容
【题目】我国国标推荐的食品药品中Ca元素含量的测定方法之一:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题:
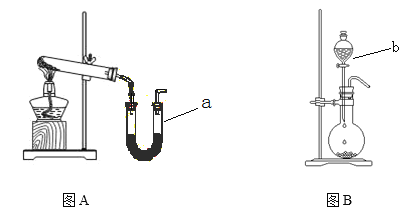
(1)KMnO4溶液应该用__(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有__。
(2)试写出滴定过程中发生反应的离子方程式:__。
(3)滴定终点的颜色变化:溶液由__色变为__色。
(4)以下哪些操作会导致测定的结果偏高__(填字母编号)。
a.装入KMnO4溶液前未润洗滴定管
b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
(5)某同学对上述实验方法进行了改进并用于测定某品牌的钙片中的钙元素(主要为CaCO3)含量,其实验过程如下:取2.00g样品加入锥形瓶中,用酸式滴定管向锥形瓶内加入20.00mL浓度为0.10mol·L-1的盐酸(盐酸过量),充分反应一段时间,用酒精灯将锥形瓶内液体加热至沸腾,数分钟后,冷却至室温,加入2~3滴酸碱指示剂,用浓度为0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液8.00mL。[提示:Ca(OH)2微溶于水,pH较低时不会沉淀]
①为使现象明显、结果准确,滴定过程中的酸碱指示剂应选择__(填“石蕊”、“甲基橙”或“酚酞”)溶液;
②实验过程中将锥形瓶内液体煮沸的目的是___;
③则此2.00g钙片中CaCO3的质量为__g。
【答案】酸式 烧杯、锥形瓶 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O 无 紫 ac 甲基橙 将溶解在溶液中的CO2气体赶出 0.06
【解析】
(1)高锰酸钾具有强氧化性,能氧化碱式滴定管的橡胶管;
(2)滴定时,高锰酸钾与草酸反应生成锰离子、二氧化碳和水;
(3)当滴入最后一滴高锰酸钾溶液时,高锰酸钾过量;
(4)a.装入KMnO4溶液前未润洗滴定管,导致高锰酸钾溶液的浓度降低,使用的体积偏大;
b.滴定结束后俯视读数,导致读取高锰酸钾溶液的体积偏小;
c.滴定结束后,滴定管尖端悬有一滴溶液,导致读取高锰酸钾溶液的体积偏大;
d.滴定过程中,振荡时将待测液洒出,导致待测液物质的量减小,使用高锰酸钾溶液的体积减小;
(5)①已知Ca(OH)2微溶于水,pH较低时不会沉淀,则滴定终点时溶液呈酸性;
②碳酸钙与盐酸反应生成二氧化碳气体;
③n(CaCO3)=![]() ×[n(HCl)-n(NaOH)]。
×[n(HCl)-n(NaOH)]。
(1)高锰酸钾具有强氧化性,能氧化碱式滴定管的橡胶管,故用酸式滴定管装盛高锰酸钾溶液,滴定时,在锥形瓶中滴定,烧杯装盛试剂;
(2)滴定时,高锰酸钾与草酸反应生成锰离子、二氧化碳和水,离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
(3)当滴入最后一滴高锰酸钾溶液时,高锰酸钾过量,则溶液由无色变为紫色;
(4)a.装入KMnO4溶液前未润洗滴定管,导致高锰酸钾溶液的浓度降低,使用的体积偏大,计算结果偏高,a符合题意;
b.滴定结束后俯视读数,导致读取高锰酸钾溶液的体积偏小,计算结果偏低,b与题意不符;
c.滴定结束后,滴定管尖端悬有一滴溶液,导致读取高锰酸钾溶液的体积偏大,计算结果偏高,c符合题意;
d.滴定过程中,振荡时将待测液洒出,导致待测液物质的量减小,使用高锰酸钾溶液的体积减小,计算结果偏低,d与题意不符;
答案为ac。
(5)①已知Ca(OH)2微溶于水,pH较低时不会沉淀,则滴定终点时溶液呈酸性,甲基橙变色范围为3.1~4.4,选甲基橙作指示剂;
②碳酸钙与盐酸反应生成二氧化碳气体,加热可降低二氧化碳的溶解度;
③n(CaCO3)=![]() ×[n(HCl)-n(NaOH)]=
×[n(HCl)-n(NaOH)]=![]() (0.1×0.02-0.1×0.008)=0.0006mol,m(CaCO3)=n(CaCO3)×100g/mol=0.06g。
(0.1×0.02-0.1×0.008)=0.0006mol,m(CaCO3)=n(CaCO3)×100g/mol=0.06g。

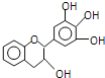
【题目】(1)青蒿素结构如图,有关叙述正确的是_____(选填序号)。
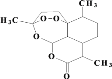
a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素,其中第2步为还原反应:
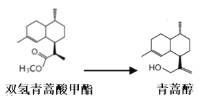
常温下即可反应且略放热,还原剂为LiAlH4。相关物质的性质:
物质 | 性质 |
双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂。 |
青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂。 |
乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点34.6℃。 |
氢化铝锂 | 固体,溶于乙醚。 与水反应:LiAlH4 + 4H2O →Al(OH)3↓+ LiOH +4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂。 (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇)。 |
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇。
(2)反应中使用过量的氢化铝锂,理由是_____________________________________________。为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是____________________。
(3)请设计实验室制备装置(画出草图):____________
(4)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂。从反应混合物中提取青蒿醇的方法是:
①加_______后分液;
②从乙醚层提取青蒿醇。有多种方法,以下是二种方案:
方案一:蒸发结晶。 方案二:蒸馏析出晶体。
a.这2个方案在析出晶体后都应有残留液,原因是___________________________________。
b.请对这2个方案进行比较_______________________________________________________。
【题目】碳酸钠有两种化合物,碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3),其中碳酸钠最为重要,在工业上有广泛的应用。在生活中,碳酸氢钠是常用的发酵剂的主要成分。完成下列计算:
(1)某天然碱的化学组成可能为aNa2CO3bNaHCO3cH2O(a、b、c为正整数),为了确定其成分:称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为____________。
(2)为了测定某发酵剂样品中碳酸氢钠的含量,取样品n克,充分灼烧以后,称的残留固体质量为m克(假设其他成分不分解)。则样品中碳酸氢钠的质量:_________(填含n、m的计算式)。
(3)已知酸性强弱顺序为:H2CO3 > HCO3- > HX。取由0.4molNaX、0.2molNa2CO3和0.1molNaHCO3组成的混合物,溶于200mL水中,往所得溶液中通入一定量的CO2气体,反应明显分两步,完成下列表格。
CO2(mol) | 0.05 | 0.15 | 0.6 |
NaX(mol) | ____ | ____ | ____ |
Na2CO3(mol) | ____ | ____ | ____ |
NaHCO3(mol) | ____ | ____ | ____ |