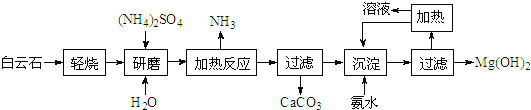
题目内容
【题目】最近有科学家提出“绿色自由”的构想:把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
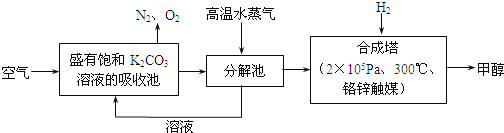
(1)在整个生产过程中饱和K2CO3溶液的作用是_______;不用KOH溶液的理由是_________。
(2)在合成塔中,每44g CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式_______________;转化过程中可循环利用的物质除了K2CO3外,还有___________。
(3)请评述合成时选择2×105Pa的理由_____________________________________。
(4)BaCO3的溶解平衡可以表示为 BaCO3(s)Ba2++CO32﹣
①写出平衡常数表达式___________________;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是_________________________。
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是______________。
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O该电池负极的电极反应式为:CH3OH﹣6e+8OH﹣=CO32﹣+6H2O则正极的电极反应式为:______________。
【答案】富集CO2 生成的K2CO3难分解产生CO2 CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol 水蒸气 适当加压有利于提高反应速率和原料利用率,但压强太高增大成本 K= c(Ba2+)c(CO32﹣) BaCO3的式量大,相对误差小 未配平两边电荷数 O2+2H2O+4e-=4 OH﹣
【解析】
(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水,碳酸钾不分解;
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子。
(1)在整个生产过程中饱和K2CO3溶液的作用是富集二氧化碳,二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,KOH溶液与二氧化碳是碳酸钾,K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5kJ热量,所以其热化学反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移,有利于提高反应速率和原料利用率,但是压强太高对反应的设备要求很高,又提高了生产成本,所以不能太高;
4)①BaCO3的溶解平衡可以表示为 BaCO3(s)Ba2++CO32﹣,平衡常数表达式为K= c(Ba2+)c(CO32﹣);
②重量法测定空气中CO2的体积分数,要求称量准确,误差小,BaCO3的式量大,称量的相对误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒,4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4中电荷不守恒,原子个数也不守恒,所以离子方程式错误;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子生成氢氧根离子,则正极反应式为:O2+2H2O+4e-=4OH﹣。

 名校课堂系列答案
名校课堂系列答案【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol·L-1) | 10 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
c(CO)/(10-3mol·L-1) | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1) 已知该反应ΔS<0,在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”“<”或“=”)。
(2)前2 s内的平均反应速率v(N2)=________。
(3)在该温度下,反应的平衡常数表达式K=________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大