题目内容
13.氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BN,如图1所示:Ⅰ.由H3BO3制备B2O3的化学方程式是2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O;
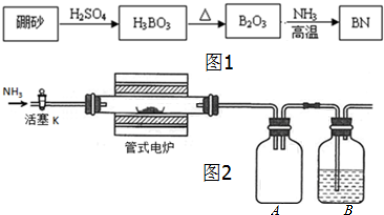
Ⅱ.某实验小组利用上述反应原理(B2O3+2NH3 $\frac{\underline{\;高温\;}}{\;}$ 2BN+3H2O)和如图2装置制备氮化硼.已知:BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水.
(1)连接好装置后,在各连接处涂抹肥皂水,然后通入N2检查气密性.证明气密性良好的现象是将装置最后的出口导管堵塞,通氮气后各连接处是没有肥皂泡出现;通入N2的另一作用是排除装置中的空气.
(2)瓶B中装有硫酸溶液,作用是吸收氨气,防止污染空气.
(3)反应结束时,关闭电炉和活塞K,并立即用弹簧夹夹紧A、B之间的橡皮管,直至电炉冷却之后再转移产物.若没有夹紧橡皮管可能观察到的现象是硫酸溶液发生倒吸.
(4)欲除去产物中未反应的B2O3并得到纯净的BN固体,实验操作过程是粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干.
分析 Ⅰ.根据元素守恒可知,H3BO3受热分解生成B2O3和水;
Ⅱ.(1)利用装置中产生的压强,如果接口密封性不好,会产生气泡,BN高温下能被空气氧化,用氮气可排除装置中的空气,以免对反应产生干扰;
(2)反应的尾气中有未反应的氨气,会污染空气;
(3)BN高温下能被空气氧化,所以产物质要冷却后才能转移,氨气极易溶于水,据此答题;
(4)根据BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水来选取操作方法;
解答 解:Ⅰ.根据元素守恒可知,H3BO3受热分解生成B2O3和水,反应方程式为2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O,
故答案为:2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O;
Ⅱ.(1)证明气密性良好的现象是将装置最后的出口导管堵塞,通氮气后各连接处是没有肥皂泡出现,BN高温下能被空气氧化,用氮气可排除装置中的空气,以免对反应产生干扰,所以反应前要排除装置中的空气,
故答案为:将装置最后的出口导管堵塞,通氮气后各连接处是没有肥皂泡出现;排除装置中的空气;
(2)反应的尾气中有未反应的氨气,会污染空气,所以瓶B中装有硫酸溶液,作用是吸收氨气,防止污染空气,
故答案为:吸收氨气,防止污染空气;
(3)BN高温下能被空气氧化,所以产物质要冷却后才能转移,所以反应结束时,要等电炉冷却之后再转移产物,氨气极易溶于水,若没有夹紧橡皮管可能观察到硫酸溶液发生倒吸,
故答案为:电炉冷却之后;硫酸溶液发生倒吸;
(4)BN高温下能被空气氧化,不溶于水;B2O3难溶于冷水但可溶于热水,所以将粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干即可得到较纯净的氮化硼,
故答案为:粗产品加入适量的热水,充分搅拌后趁热过滤,用热水洗涤滤渣2~3次,烘干.
点评 本题考查了实验制备方案的设计,此种类型是考试的热点,设计实验时要根据实验目的选取实验装置和实验药品,题目难度中等,注意实验基本操作和元素化合物质知识的灵活运用.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案| A. | 2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA | |
| B. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个 | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |

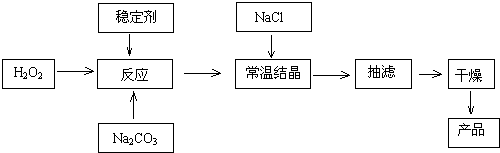

 二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料. (1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2
(1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2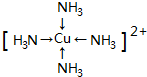
 .
.