题目内容
8.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA | |
| B. | 1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个 | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
分析 A、求出铝的物质的量,然后根据反应后铝元素变为+3价来分析;
B、铝在浓硫酸和浓硝酸中会钝化;
C、求出铁的物质的量,然后根据铁与盐酸反应后变为+2价,而与氯气反应后变为+3价来分析;
D、根据反应后钠元素变为+1价来分析.
解答 解:A、2.7g铝的物质的量为0.1mol,而反应后铝元素变为+3价,故0.1mol铝反应后转移0.3mol电子即0.3NA个,故A错误;
B、铝在浓硫酸和浓硝酸中会钝化,故1mol铝不能完全反应,故转移的电子数小于3NA个,故B错误;
C、5.6g铁的物质的量为0.1mol,而铁与盐酸反应后变为+2价,故0.1mol铁转移0.2mol电子即0.2NA个,而与氯气反应后变为+3价,故0.1mol铁转移0.3mol电子即0.3NA个,故C错误;
D、由于反应后钠元素变为+1价,故1mol钠无论反应后的产物是什么,均转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
18.在塑料袋中放一个成熟的苹果,再放些青香蕉,将袋口密封.两天后,发现青香蕉成熟了.导致青香蕉成熟的物质是成熟苹果释放出的( )
| A. | C2H4 | B. | CH3COOH | C. | C6H6 | D. | CH3CH2OH |
19.下列“油”中都属于油脂的是( )
①豆油 ②酱油 ③牛油 ④甘油 ⑤汽油.
①豆油 ②酱油 ③牛油 ④甘油 ⑤汽油.
| A. | ①③ | B. | ②④ | C. | ①⑤ | D. | ④⑤ |
3.利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
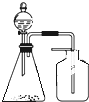

| A. | FeS与稀硫酸 | B. | 铜与浓硫酸 | C. | 稀硝酸与铜片 | D. | 电石与水 |
13.由下列反应式所得出的结论中正确的是( )
| A. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | NH3+H3O+═NH4++H2O:NH3结合H+的能力比H2O强 | |
| D. | 已知C(s,石墨)═C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
20.X、Y、Z和R为原子序数依次递增的四种元素.其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素.下列说法不正确的是( )
| A. | 127R-的核外含有53电子 | |
| B. | Y、Z、R的氢化物的稳定性逐渐减弱 | |
| C. | Z的单质易挥发,可以水封保存 | |
| D. | 在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色 |
14.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓..
(2)凝聚剂除去悬浮固体颗粒的过程③(填序号).FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀.
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是除去除去Ca2+和调节PH值.
(4)气体A的作用是强氧化.这种作用是基于气体A和水反应的产物具有Cl2+H2O=H++Cl-+HClO性.
(5)下列物质中①③可以作为气体A的代用品.
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5mol•L-1 |
| 细菌总数 | <100个/mL |

(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:Ca2++HCO-3+OH-=CaCO3↓+H2O,?Mg2++2HCO-3+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O,Mg2++2OH-=Mg(OH)2↓..
(2)凝聚剂除去悬浮固体颗粒的过程③(填序号).FeSO4•7H2O是常用的凝聚剂,它在水中最终生成胶状Fe(OH)3沉淀.
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是除去除去Ca2+和调节PH值.
(4)气体A的作用是强氧化.这种作用是基于气体A和水反应的产物具有Cl2+H2O=H++Cl-+HClO性.
(5)下列物质中①③可以作为气体A的代用品.
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
