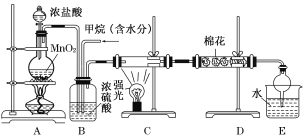
题目内容
【题目】用铂电极电解100mLHNO3 与AgNO3 的混合液,通电一段时间后,两极均收集到4.48L气体(标准状况),则原混合液中Ag+的物质的量浓度为( )
A. 1mol·L-1B. 2mol·L-1C. 2.5mol·L-1D. 4mol·L-1
【答案】D
【解析】
铂电极为惰性电极,电解HNO3与AgNO3的混合溶液,通电一段时间后,两极均收集到4.48L气体(标准状况),阴极发生2Ag++2e-=2Ag、2H++2e-=H2↑,阳极发生4OH--4e-=2H2O+O2↑,以此进行计算。
铂电极为惰性电极,电解HNO3与AgNO3的混合溶液,通电一段时间后,两极均收集到4.48L气体(标准状况),n(气体)=![]() =0.2mol,由阳极发生4OH--4e-=2H2O+O2↑可知,生成0.2molO2转移0.8mol电子,根据电子守恒可知,阴极转移0.8mol电子,则:
=0.2mol,由阳极发生4OH--4e-=2H2O+O2↑可知,生成0.2molO2转移0.8mol电子,根据电子守恒可知,阴极转移0.8mol电子,则:
2H++2e-=H2↑
0.4mol 0.2mol
2Ag++2e-=2Ag
0.4mol 0.4mol
即n(Ag+)=0.4mol,
则原混合溶液中Ag+的物质的量浓度为![]() =4mol/L,故答案为D。
=4mol/L,故答案为D。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目