题目内容
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3 mol电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)________L。
(2)反应②中________作氧化剂,________是氧化产物。
(3)当反应②中生成11.2 L SO2气体(标准状况下)时,被还原的H2SO4的物质的量是________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)__________。
(5)反应③中氧化产物与还原产物的物质的量之比为__________。
【答案】147 33.6 H2SO4(浓); CuSO4 0.5 mol 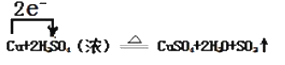 5:1
5:1
【解析】
(1)反应①中1mol Fe参与反应,消耗稀硫酸1mol,电子转移2mol。
(2)由反应方程式可知,反应中Cu从0价升高到+2价,失去电子,发生氧化反应,S从+6价降低到+4价,得到电子,发生还原反应;
(3)反应②中,生成1mol SO2气体,被还原的H2SO4的物质的量为1mol;
(4)反应②中S从+6价降低到+4价,得到电子,发生还原反应, Cu从0价升高到+2价,失去电子,发生氧化反应;
(5)反应③中Cl从+5价降低到0价,从-1价升高到0价,Cl2既是氧化产物又是还原产物;
(1)当反应①转移3 mol电子时,消耗H2SO4的的物质的量为1.5mol,质量为1.5mol×98g/mol=147g;产生氢气的物质的量为1.5mol,标况下的体积为1.5mol×22.4L/mol=33.6L;
(2)反应②中S从+6价降低到+4价,得到电子,发生还原反应,硫酸为氧化剂,Cu从0价升高到+2价,失去电子,发生氧化反应,Cu为还原剂,得到的产物CuSO4为氧化产物;
(3)当反应②中生成11.2 L (即0.5mol)SO2气体时,被还原的H2SO4的物质的量是0.5mol;
(4)反应②中S从+6价降低到+4价,得到电子,发生还原反应, Cu从0价升高到+2价,失去电子,发生氧化反应,因此电子转移的方向和数目为: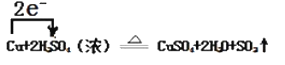 ;
;
(5)反应③中Cl2既是氧化产物又是还原产物,物质的量之比为5:1。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
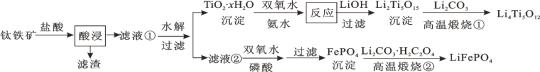
下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFeO4+H2O↑+3CO2↑
2LiFeO4+H2O↑+3CO2↑
D.TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
可知,40℃前,未达到平衡状态,随着温度升高,转化率变大