题目内容
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
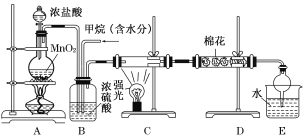
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A.分液法 B.蒸馏法 C.结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。
【答案】(1) CH4+Cl2 ![]() CH3Cl+HCl,正确;(2)干燥气体;(3) KI-淀粉;(4)A;(5)3mol,3mol。
CH3Cl+HCl,正确;(2)干燥气体;(3) KI-淀粉;(4)A;(5)3mol,3mol。
【解析】
试题分析:(1)甲烷和氯气发生取代反应,生成一氯代烷的方程式为:CH4+Cl2 ![]() CH3Cl+HCl,有可能是氯气和水反应产生HCl,故此同学说法正确;(2)盛放的是浓硫酸,利用浓硫酸的吸水性,作干燥剂,即干燥Cl2;(3)蓝色一般可能是无水硫酸铜与水变蓝,也可能是淀粉与碘单质变蓝,根据装置图,只能是淀粉遇碘变蓝,因此棉花上淀粉-KI溶液,利用氯气把碘置换出来;(4)有机物为卤代物,不溶于水,可以采用分液的方法进行分离,故选项A正确;(5)设CH3Cl为xmol,则CH2Cl2为x+0.1,CHCl3为x+0.2,CCl4为x+0.3,根据碳原子守恒,x+x+0.1+x+0.2+x+0.3=1,解得x=0.1,因此消耗氯气的物质的量为(0.1+0.2×2+0.3×3+0.4×4)mol=3mol,消耗氯气的物质的量等于生成HCl物质的量,即3mol。
CH3Cl+HCl,有可能是氯气和水反应产生HCl,故此同学说法正确;(2)盛放的是浓硫酸,利用浓硫酸的吸水性,作干燥剂,即干燥Cl2;(3)蓝色一般可能是无水硫酸铜与水变蓝,也可能是淀粉与碘单质变蓝,根据装置图,只能是淀粉遇碘变蓝,因此棉花上淀粉-KI溶液,利用氯气把碘置换出来;(4)有机物为卤代物,不溶于水,可以采用分液的方法进行分离,故选项A正确;(5)设CH3Cl为xmol,则CH2Cl2为x+0.1,CHCl3为x+0.2,CCl4为x+0.3,根据碳原子守恒,x+x+0.1+x+0.2+x+0.3=1,解得x=0.1,因此消耗氯气的物质的量为(0.1+0.2×2+0.3×3+0.4×4)mol=3mol,消耗氯气的物质的量等于生成HCl物质的量,即3mol。

【题目】实验室用密度为1.25 gmL﹣1、质量分数为36.5%的浓盐酸配制240 mL 0.1 molL﹣1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为________________________。
(2)配制240 mL 0.1 molL﹣1的盐酸
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
__________ | __________ |
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)__________。
A.用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对配制盐酸的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用于稀释盐酸的烧杯未洗涤__________________________________________;
②容量瓶中原有少量蒸馏水____________________________________________;
③定容时俯视观察液面________________________________________________。
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度________________________________________;
②向容量瓶中转移溶液时不慎有溶液溅出________________________________;
③定容摇匀后发现液面下降____________________________________________。