题目内容
【题目】利用传感技术可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是( )
N2O4(g)化学平衡移动的影响。在室温、100kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是( )
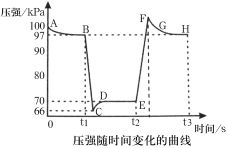
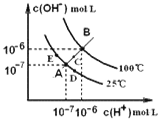
A.B点处NO2的转化率为3%
B.E点到H点的过程中,NO2的物质的量先增大后减小
C.E、H两点对应的正反应速率大小为vH>vE
D.B、E两点气体的平均相对分子质量大小为MB>ME
【答案】CD
【解析】
A.由图可知B点处压强为97KPa,设起始二氧化氮为1mol,转化率为a,由题意建立如下三段式:
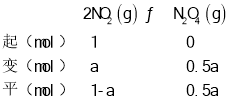
由![]() 可得
可得![]() ,解得a=0.06,即二氧化氮的转化率为6%,故A错误;
,解得a=0.06,即二氧化氮的转化率为6%,故A错误;
B.由图可知,t2时刻移动了活塞,压强迅速增大,说明迅速移动活塞使针筒体积减小,并保持活塞位置不变后,体系因体积减小而压强增大,平衡向生成四氧化二氮的方向移动,则E点到H点的过程中,二氧化氮的物质的量是一个减小过程,故B错误;
C.对于有气体参加的反应,压强越大反应速率越大,由图可知,H点压强大于E点,则反应速率vH>vE,故C正确;
D.由图可知,B到E的过程为压强减小的过程,减小压强平衡向生成二氧化氮的方向移动,气体的物质的量增大,由质量守恒定律可知气体质量不变,则混合气体的平均相对分子质量减小,即MB>ME,故D正确;
故选CD。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目