题目内容
16.下列事实能说明某物质是强电解质的是( )| A. | 该物质在水中的溶解度大 | |
| B. | 该物质的水溶液导电能力强 | |
| C. | 该物质的水溶液中不存在溶质分子 | |
| D. | 该物质的水溶液中不存在除水外的电离平衡 |
分析 完全电离的电解质为强电解质,强酸、强碱和大部分的盐、金属氧化物等都是强电解质.
解答 解:A、易溶于水的物质不一定是强电解质,如醋酸,即电解质的强弱与溶解度无关,故A错误;
B、水溶液能导电能力强的物质不一定是强电解质,如醋酸为弱电解质,导电能力强于硫酸钡(微溶,溶解部分完全电离),即导电能力与电解质强弱无关,故B错误;
C、该物质的水溶液中不存在溶质分子,说明完全电离,是强电解质,故C正确;
D、该物质的水溶液中不存在除水外的电离平衡,说明完全电离,故D正确,故选CD.
点评 本题考查了强电解质的判断,根据电解质的电离程度划分强弱电解质,与溶液的导电性、是否挥发、物质的溶解性等都无关,为易错点.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
6.设NA为阿伏加德罗常数的值.下列说法一定正确的是( )
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |
4.常温下,下列有关叙述正确的是( )
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
1.近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法正确的是( )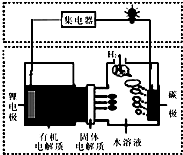

| A. | 碳极发生的反应是:2H2O+O2+4e-═4OH- | |
| B. | 有机电解质通过固体电解质可进入水溶液中 | |
| C. | 理论上,外电路中每转移1mol电子,负极消耗的质量为7g | |
| D. | 该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极 |
8.已知25℃、101kPa下,下列反应
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |
6.下列物质具有固定熔沸点的是( )
| A. | 钢化玻璃 | B. | 漂白粉 | C. | 消石灰 | D. | 水玻璃 |
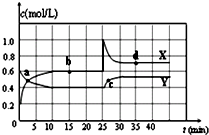 在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.