题目内容
14.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是( )
| A. | 1个乙分子中含有3个A原子 | B. | 该反应类型是分解反应 | ||
| C. | 反应生成的丙物质属于单质 | D. | 化学反应中分子的种类发生了改变 |
分析 图示可以推出甲、丙的化学式可分别表示为A3B、B2.根据质量守恒定律化学反应前后原子的个数不变,可知3个乙分子中共含有6个A原子,则乙的化学式可表示为A2;分子由原子构成,同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子.
解答 解:A、据图可知,甲、丙的化学式可分别表示为A3B、B2.根据质量守恒定律化学反应前后原子的种类、个数都不变,可知3个乙分子中共含有6个A原子,即每个乙分子中含有2个A原子,则乙的化学式可表示为A2.用化学方程表示这个化学反应为:2A3B═3A2+B2,由一种分子变成了两种分子,故A错误;
B、由一种分子变成了两种分子,属于分解反应.故B正确;
C、丙物质的分子由2个B原子构成,即物质丙由元素B组成的单质;故C正确;
D、根据质量守恒定律,化学变化前后原子种类、数目不变,反应前后分子种类发生改变,故D正确;故选A.
点评 本题属于微观示意图的考查,解题的关键是能够根据微观的分子结构分析物质的组成,然后结合相关的知识逐项分析;注意质量守恒定律和阿伏加德罗定律的区别.

练习册系列答案
相关题目
4.常温下,下列有关叙述正确的是( )
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
2.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的( )
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 氯水可以导电(Cl2) | |
| C. | 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
9.请根据下面信息,判断下列叙述中正确的是( )

| A. | 1mol H2O 分解为H2与O2需吸收930 kJ热量 | |
| B. | H与O反应生成1mol H2O放出930 kJ热量 | |
| C. | 2 mol H的能量小于1mol H2的能量 | |
| D. | H结合成H2放出436 kJ的热量 |
19.下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
| A. | 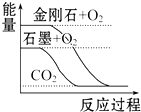 石墨转变为金刚石是吸热反应 | |
| B. | 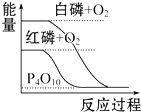 白磷比红磷稳定 | |
| C. | 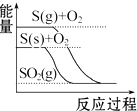 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 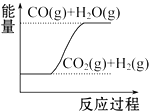 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
6.下列物质具有固定熔沸点的是( )
| A. | 钢化玻璃 | B. | 漂白粉 | C. | 消石灰 | D. | 水玻璃 |
3.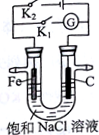 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| B. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48L气体 |
4.化学与人类生活密切相关,下列说法正确的是( )
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 能将工业酒精兑水后饮用,因为其中含有甲醇,它具有醇香味 |
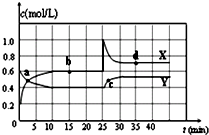 在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.