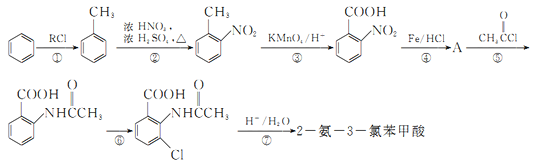
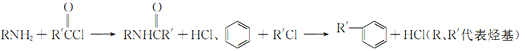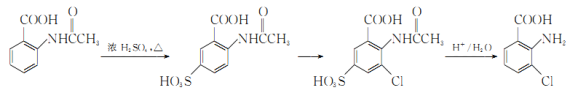题目内容
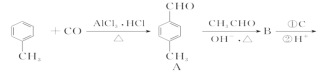
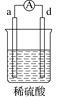
【题目】(1)我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2![]() Si3N4+6CO,该反应变化过程中的能量变化如图所示。
Si3N4+6CO,该反应变化过程中的能量变化如图所示。

回答以下问题。
(1)该反应________(填“吸热”或“放热”),反应热ΔH________0(填“>”、“<”或“=”)。
(2)已知:
As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=__________。
(3)氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。已知:
①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=![]() ,写出此反应的热化学方程式:____________。
,写出此反应的热化学方程式:____________。
(4)甲烷的燃烧热为890.3 kJ/ mol ,请写出表示CH4燃烧热的热化学方程式_____________。
(5)由图可知,金刚石的稳定性________石墨的稳定性(填“>”、“<”或“=”)。
(6)中和热的测定装置如图所示:
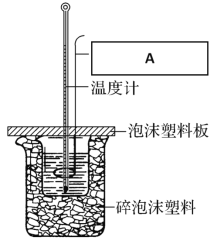
图中A的仪器名称:__________________作用:____________________________
【答案】放热 < 2ΔH1-3ΔH2-ΔH3 2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 小于 环形玻璃搅拌棒 搅拌使其充分反应
【解析】
根据反应前后物质所含能量的大小关系可分析出反应吸放热类型;根据盖斯定律,通过其他焓变已知的热化学方程式即可计算未知反应的焓变;根据平衡常数表达式可书写出相应的反应方程式,再根据盖斯定律借助其他焓变已知的热化学方程式即可计算未知反应的焓变;书写表示燃烧热的热化学方程式时,一定要注意燃烧热的定义;根据物质所含能量的多少,即可判断物质的稳定性;在测定中和热的实验中,用到的最为特别的仪器即为环形玻璃搅拌棒,一方面要注意该仪器的材质为玻璃,另一方面注意该仪器并非普通的玻璃搅拌棒,但作用几乎等同。
(1)由图可知,反应物的能量更高,因此该反应是放热反应,![]() ;
;
(2)由题可知,方程式Ⅳ:![]() 可由方程式Ⅰ:
可由方程式Ⅰ:![]() 和方程式Ⅱ:
和方程式Ⅱ:![]() 以及方程式Ⅲ:
以及方程式Ⅲ:![]() ,经过如下运算得到:Ⅳ=2Ⅰ-3Ⅱ-Ⅲ;因此其焓变可表示为:
,经过如下运算得到:Ⅳ=2Ⅰ-3Ⅱ-Ⅲ;因此其焓变可表示为:![]() ;
;
(3)由平衡常数表达式可知,该反应的方程式为④:![]() ;其可由方程式①②③经过如下运算得到:④=①-③+2②,即方程式④的焓变可表示为ΔH4=ΔH1-ΔH3+2ΔH2,代入数据计算可得该反应焓变为-746.5kJ/mol,因此该反应的热化学方程式为:
;其可由方程式①②③经过如下运算得到:④=①-③+2②,即方程式④的焓变可表示为ΔH4=ΔH1-ΔH3+2ΔH2,代入数据计算可得该反应焓变为-746.5kJ/mol,因此该反应的热化学方程式为:![]()
![]() ;
;
(4)甲烷的燃烧热为890.3kJ/mol,即1mol甲烷完全燃烧生成CO2和液态水会放出890.3kJ的热量,所以表示甲烷燃烧热的热化学方程式为:![]()
![]() ;
;
(5)由图可知,金刚石所含的能量更高,所含能量越高的物质越不稳定,因此金刚石稳定性小于石墨的稳定性;
(6)在测定中和热的实验中,使用的A是环形玻璃搅拌棒,其作用即搅拌溶液使酸与碱能充分反应。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
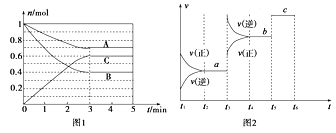
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
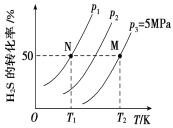
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
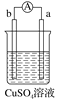
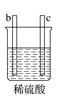
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c