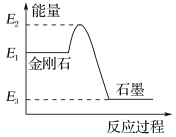
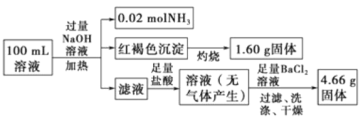
题目内容
【题目】已知![]() 某溶液中可能存在
某溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等7种离子中的某几种,分别进行如下实验:
等7种离子中的某几种,分别进行如下实验:
![]() 向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
![]() 向所得橙色溶液中加入足量
向所得橙色溶液中加入足量![]() 溶液,无沉淀生成;
溶液,无沉淀生成;
![]() 向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
则下列说法正确的是![]()
A.肯定没有![]() B.肯定有
B.肯定有![]() 、
、![]()
C.可能有![]() D.可能有
D.可能有![]()
【答案】B
【解析】
![]() 向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有
向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有![]() ,且有无色气泡冒出,说明溶液中含离子
,且有无色气泡冒出,说明溶液中含离子![]() ;
;
![]() 向所得橙色溶液中加入足量
向所得橙色溶液中加入足量![]() 溶液,无沉淀生成,说明不含
溶液,无沉淀生成,说明不含![]() ;
;
![]() 向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含
向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子或溶液中不含![]() ,所以溶液不变色,不能确定碘离子存在;
,所以溶液不变色,不能确定碘离子存在;
溶液中含有![]() ,则一定不含有
,则一定不含有![]() 、
、![]() ,因与
,因与![]() 反应生成沉淀,
反应生成沉淀,
根据溶液呈电中性原则,溶液中一定含有![]() , 所以溶液中一定不存在的离子为
, 所以溶液中一定不存在的离子为![]() 、
、![]() 、
、![]() ,一定含有的离子为
,一定含有的离子为![]() 、
、![]() 、
、![]() ,不能确定碘离子存在。
,不能确定碘离子存在。
故选:B。

【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性高锰酸钾溶液中通入SO2 | 溶液颜色褪去 | SO2具有漂白性 |
B | 将少量铜粉加入FeCl3溶液中 | 铜粉消失 | 还原性:Cu>Fe2+ |
C | 向溶液X中先滴加稀硝酸,再滴加氯化钡溶液 | 有白色沉淀生成 | 溶液X中含有SO |
D | 锌与稀硫酸反应制取氢气时,加入少量硫酸铜溶液 | 反应速率加快 | Cu2+起催化作用 |
A.AB.BC.CD.D
【题目】在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | a | 0.55 | 0 | 0.5 |
Ⅲ | T | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.反应Ⅲ的温度T<500℃
C.容器Ⅱ中起始时CO的物质的量为1.0 mol
D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80%]