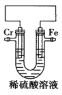
题目内容
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的红色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)Q在元素周期表中的位置为___,YX3的电子式为____(用元素符号表示)。
(2)X、Y、Z原子的半径从大到小的顺序是______(用元素符号表示)。
(3)X2Q与Y的最高价氧化物的水化物的稀溶液反应会生成Q单质,试写出该反应的化学方程式___。
(4)能证明R的非金属性比Q强的实验事实是____(填字母序号)。
a.R2与H2化合比Q与H2化合容易,且HR的稳定性比H2Q强
b.H2Q的水溶液中通少量的R2气体可置换出单质Q
c.HR的水溶液酸性比H2Q的水溶液酸性强
(5)气体YX3在水中的溶解性特别大的原因是________。
【答案】第三周期ⅥA 族 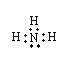 Na>N>H 3H2S+2HNO3=3S↓+2NO↑+4H2O ab NH3与H2O分子之间能够形成氢键
Na>N>H 3H2S+2HNO3=3S↓+2NO↑+4H2O ab NH3与H2O分子之间能够形成氢键
【解析】
X、Y、Z、Q、R是原子序数依次增大的短周期主族元素,气体YX3能使润湿的红色石蕊试纸变蓝,该气体为氨气,则Y为N,X为H,Z和X在同一主族,则Z为Na,Q原子的最外层电子数是其周期序数的2倍,即最外层有6个电子,所以Q为S,则R为Cl,据此答题。
根据上述分析可知,X、Y、Z、Q、R分别是H、N、Na、S和Cl,则:
(1)Q为S,原子序数为16,在元素周期表中的位置为第三周期ⅥA族;NH3的电子式为; ;
;
(2)电子层数越多,原子半径越大,所以H、N、Na原子的半径从大到小的顺序是Na>N>H;
(3)N的最高价氧化物的水化物的稀溶液为硝酸,H2S 与HNO3发生氧化还原反应会生成 S单质,其化学方程式为:3H2S+2HNO3=3S↓+2NO↑+4H2O;
(4)a. 元素的非金属性越强,气态氢化物越稳定,所以Cl2与H2化合比S与H2化合容易,且HCl的稳定性比H2S强,能证明氯的非金属性比硫强,a项正确;
b. H2S的水溶液中通少量的Cl2气体可置换出单质S,说明Cl2的氧化性强于S,所以能证明氯的非金属性比硫强,b项正确;
c. 元素的最高价氧化物的水化物的酸性越强,元素的非金属性越强,HCl的水溶液酸性比H2S的水溶液酸性强,不能说明氯的非金属性比硫强,c项错误;故选ab。
气体NH3在水中的溶解性特别大主要是因为NH3与H2O分子之间能够形成氢键。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】以硼镁泥为原料制取的硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2O的流程如下:

(1)实验中需用3 mol·L-1的硫酸500 mL,若用98%的浓硫酸(ρ=1.84 g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+反应,方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,
欲使2moL Mn2+被氧化则至少需要氧化剂NaClO质量为______g;还有一种离子也会被NaClO氧化,该反应的离子方程式为______________________________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有________、_________。
(4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100 g水):
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)若实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为86.1 g,则MgSO4·7H2O的产率为__________。