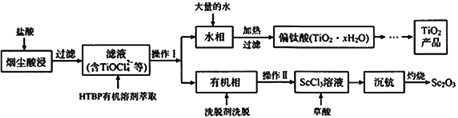
题目内容
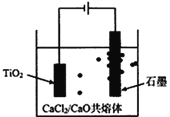
【题目】某化学兴趣小组为了探究铬和铁的活泼性,设计如图所示装置,下列推断合理的是( )

A. 若铬比铁活泼,则电子经外电路由铁电极流向铬电极
B. 若铁比铬活泼,则溶液中H+向铁电极迁移
C. 若铬比铁活泼,则铁电极反应式为2H++2e-=H2↑
D. 若铁电极附近溶液pH增大,则铁比铬活泼
【答案】C
【解析】
若铬比铁活泼,则负极为铬失电子发生氧化反应,正极为铁,氢离子在铁上得电子发生还原反应,电子经外电路由铬电极流向铁电极;若铁比铬活泼,则负极为铁失电子发生氧化反应,正极为铬,氢离子在铬上得电子发生还原反应,电子经外电路由铁电极流向铬电极。
A. 若铬比铁活泼,则负极为铬失电子发生氧化反应,正极为铁,电子经外电路由铬电极流向铁电极,A项错误;
B. 若铁比铬活泼,则负极为铁失电子发生氧化反应,正极为铬,溶液中的氢离子在正极得电子,氢离子向正极铬移动,B项错误;
C. 若铬比铁活泼,则负极为铬失电子发生氧化反应,正极为铁,氢离子在铁上得电子发生还原反应,反应式为2H++2e-=H2↑,C项正确;
D. 若铁电极附近溶液pH增大,则发生2H++2e-=H2↑,所以铁为正极,则铬比铁活泼,D项错误。
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是_______反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率υ(N2)=___________,t1℃时该反应的平衡常数K=________。
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是_______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
则处理汽车尾气反应中的a=__________。
(5)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
NO | N2 | CO2 | |
起始浓度/mol·L-1 | 0.10 | 0 | 0 |
平衡浓度/mol·L-1 | 0.04 | 0.03 | 0.03 |
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5:3:3,则ΔH4_______0(填“ >”、“=”或“<”)。
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
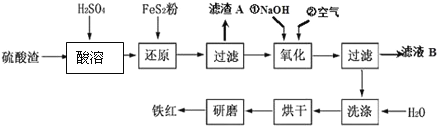
回答下列问题:
(1)酸溶时,粉碎硫酸渣的目的是_________________________________________。
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,完成该反应的离子方程式:_________FeS2+14Fe3++______H2O═15Fe2++______SO42-+______.
(3)滤渣A的主要成分为_________。
(4)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是___________;(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
为得到纯净的Fe(OH)3固体,需要对沉淀进行洗涤,判断沉淀Fe(OH)3是否洗净的方法是____________________。
(5)当离子浓度≤1×10-5mol/L时可认为其沉淀完全。若要使Mg2+完全沉淀则要保持c(OH-)≥_____________。(已知Ksp[Mg(OH)2]=5.6×10-12,![]() )
)