äãá¢áÖàï
Àƒäãá¢À¢Ý§òúØ£øøøÄ؈çá£₤¿ÊåÙêüȘØýòúØ£øøøÄ؈çáàÉ¥êÀÈúŠ£ÄÇÞüôêÅöòäãȤ

È´1Èˋèüë¥òúá°ÅˋÆÅ£ºöÿçá§Ã¿¿áÈÅëȘóðøÅÝÚòƒöˆÝ§çáòú_____ÀÈ
È´2Èˋü·2mLݧøÅ¥ÆàŠ1mLðÍùÛȘíÞçÇÀƒýøûȘòçîÕüøüµöˆ_____ÀÈ
È´3ÈˋåÖأѴ侥±üôȘݧáÉñÂèºÑÁøøàÀǺñÇÆÎÀÈÅÇ°—ݧ躰èü¾£ªÝ§çá£₤îÏñ§°äò§____ÀÈ
È´4ÈˋåÖأѴ侥±üôȘݧ¢èØåÆèØØàýøóçûȘÅÇ°—ØØàýÆŠæÐê¢çáH2åÖ¥Æàà¥Æî¿È˜Niæ—ÇÔ£₤¥êçáä¾¥±üôñÇÆÎ躰èØØëÕçá£₤îÏñ§°äò§_____ÀÈ
ÀƒÇÞ¯¡À¢D àÉؤñøýÐȘèüýÐöˆ°à¤šè¨È´£·°à£óè¨ÈˋȘüôýÐöˆößè¨ÀÈ ![]() +HNO3
+HNO3 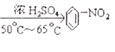 +H2O HCÀåCH + 2H2
+H2O HCÀåCH + 2H2![]() CH3CH3
CH3CH3
Àƒ§ãö—À¢
È´1Èˋ1¡—ݧñøæÆÆè6¡—ä¥åÙæƤë6¡—úãåÙæÆ¿¿°èȘ¡ªƒï¡¼öÿøòçá§Ã¿¿äÄçÐæ¼ÇÞÈ£
È´2ÈˋݧƊðÍùÛý£ñÇÆÎȘ稣ÃñÂèºïëàÀȘƒïÇùñøö—òçîÕüøüµÈ£
È´3Èˋ¡ªƒïݧçáûÉÑàÅÀÆÖùÛȘݧñøæÆøÅçá¥■òú§ÕÆÖçË¥■¤ëù¨¥■øÛ¥ðçáØ£øøäÄòã¥■Ș§Ã¤üݧƊé´ü¾ùÃåÖأѴ侥±üôñÂèºàÀǺñÇÆÎ躰èü¾£ªÝ§ñøö—È£
È´4Èˋ§Ã¤üØîøˆä¾¥±æ¼ÇÞÀÈ
È´1Èˋèüò—§Ã¿¿çáÝàâ»áÈÅëøÅȘAöˆ¥æëÕȘBöˆØØüˋȘCöˆÝ«ëÕȘDöˆÝ§È˜¿òÝÚòƒöˆÝ§çáòúDÈ£
È´2Èˋ2mLݧøÅ¥ÆàŠ1 mLðÍùÛȘݧý£àÉÆÖùÛȘúØûÉÑàÝàùÛÅÀȘå·àÉؤ£ÃñøýÐȘBr2£ÃÝ£ïëàÀç§Ý§ýÐèüüå°à¤šè¨È˜å·üøüµöˆÈ¤àÉؤñøýÐȘèüýÐöˆ°à¤šè¨È´£·°à£óè¨ÈˋȘüôýÐöˆößè¨È£
È´3Èˋݧ£ÃÆŠé´ü¾ùÃȘåÖé´ê·ùÃÇÔ£₤æ¼ÆûüôȘùÛåÀ¥Æààç§50-65ÀÐC¤µñÂèºàÀǺñÇÆÎ躰èü¾£ªÝ§¤ëùÛȘóð£₤îÏñ§°äò§öˆÈ¤![]() +HNO3
+HNO3 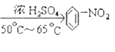 +H2OÈ£
+H2OÈ£
È´4ÈˋØØàýÆŠæÐê¢çá H2 åÖ¥Æàà¥Æî¿È˜Ni æ—ÇÔ£₤¥êçáä¾¥±üôñÂ躥ưèñÇÆÎ躰èØØëÕȘóð£₤îÏñ§°äò§öˆÈ¤HCÀåCH + 2H2![]() CH3CH3ÀÈ
CH3CH3ÀÈ

Àƒäãá¢À¢ó«°çöýó½øÅçáø¼ØˆöÜàƒöÿòúNOØ奯à¥êüý£ëõà¨à¥èíùªýºèºçáCOÀÈöˆêù¥¾úÃǵó½öÜàƒÈ˜àùûúäð—ë´¿»ØåüôñÇÆÎâÇÇÎâÚó«°çöýó½È¤2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ÎÊH = a kJÀÊmol-1ÀÈöˆêùýãÑ´åÖá°øøÇÔ£₤¥êæ¼Æûüô¡ûñÇÆÎçáñÇÆÎùìôòȘt1ÀÌüôȘåÖأѴàïçáûÉÝíàïó¼øÅȘᰢóîÅ£º¿¿Æûó½äÍǨ¡Åó¼ýãçûêùý£ë˜òÝ¥ðçáNO¤ëCOçáé´ÑààÓüôÝÚÈ´CO2¤ëN2çáóÞò¥é´Ñàƒªöˆ0ÈˋÀÈ
2CO2(g)+N2(g) ÎÊH = a kJÀÊmol-1ÀÈöˆêùýãÑ´åÖá°øøÇÔ£₤¥êæ¼Æûüô¡ûñÇÆÎçáñÇÆÎùìôòȘt1ÀÌüôȘåÖأѴàïçáûÉÝíàïó¼øÅȘᰢóîÅ£º¿¿Æûó½äÍǨ¡Åó¼ýãçûêùý£ë˜òÝ¥ðçáNO¤ëCOçáé´ÑààÓüôÝÚÈ´CO2¤ëN2çáóÞò¥é´Ñàƒªöˆ0ÈˋÀÈ
òÝ¥ð (s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
£ÄÇÞüôêÅöòäãȤ
È´1ÈˋåÖèüò—ä¾¥±üô¡ûñÇÆÎáÉæåñ§½ÅÅȘå·í»ñÇÆÎÝÄà£òú_______ñÇÆÎÈ´äŸÀ¯ñéààÀÝ£·À¯ö■ààÀÝÈˋÀÈ
È´2Èˋú¯3sáÖçá󧃪ñÇÆÎùìôòÎå(N2)=___________Șt1ÀÌòÝ¡ûñÇÆÎçáó§¤ã°Èò»K=________ÀÈ
È´3Èˋ¥ìèÒåÖûÉÝíàïó¼øÅñÂèºèüò—ñÇÆÎȘÇÿç§ó§¤ãòÝ¡áÝðüôêÅä¾¥±È˜áÉäáÔNO戣₤ôòçáòú_______ÀÈ
AÈÛîÀÆû¡■ÆÅÅÏçáÇÔ£₤¥ê BÈÛ軡ÔñÇÆÎäÍüççáöôÑà
CÈÛ§ççëñÇÆÎäÍüççáöôÑà DÈÛù¾ÅÀàïó¼çáäÍ£»
È´4ÈˋØîøˆÈ¤N2(g)+O2(g)=2NO(g) ÎÊH1=Ȩ180.5 kJÀÊmol-1
2C(s)+O2(g)=2CO(g) ÎÊH2ȧÈÙ221.0 kJÀÊmol-1
C(s)+O2(g)=CO2(g) ÎÊH3ȧÈÙ393.5 kJÀÊmol-1
å·ÇÎâÚó«°çöýó½ñÇÆÎøÅçáa=__________ÀÈ
È´5ÈˋÆû£ŸÅå䢣¿åÙñ´Øý¢èØåÇÎâÚçˆî¾£₤öÿȘÆÅ¿ÄñÇÆÎöˆÈ¤C(s)+2NO(g) ![]() CO2(g)+N2(g) ÎÊH4ÀÈü·á°ûÉÝíàïó¼¥ÆàŠØ£Ñ´ê¢çᣟÅå䢤ëNOȘåÖt2ÀÌüôñÇÆÎȘÆÅ¿Äò»ƒïàÓüôÝÚȤ
CO2(g)+N2(g) ÎÊH4ÀÈü·á°ûÉÝíàïó¼¥ÆàŠØ£Ñ´ê¢çᣟÅå䢤ëNOȘåÖt2ÀÌüôñÇÆÎȘÆÅ¿Äò»ƒïàÓüôÝÚȤ
NO | N2 | CO2 | |
óÞò¥é´Ñà/molÀÊL-1 | 0.10 | 0 | 0 |
ó§¤ãé´Ñà/molÀÊL-1 | 0.04 | 0.03 | 0.03 |
ó§¤ã¤µè»¡ÔöôÑàȘåìÇöÇÿç§ó§¤ãýãçûàïó¼øÅNOÀÂN2ÀÂCO2çáé´ÑàøÛÝàöˆ5:3:3Șå·ÎÊH4_______0È´äŸÀ¯ >ÀÝÀÂÀ¯=ÀÝ£·À¯<ÀÝÈˋÀÈ
Àƒäãá¢À¢Øå£ó亢µöˆåÙêüøóê·ùÃýºèºçáê·ùÃå■øŤ˜Fe2O3ÀÂSiO2ÀÂAl2O3ÀÂMgOçàȘÆûê·ùÃå■øóݡ交šÈ´Fe2O3Èˋçá¿»°äàÓüôȤ

£ÄÇÞüôêÅöòäãȤ
È´1ÈˋùÃàÉòÝȘñÜùÕê·ùÃå■çáá¢çáòú_________________________________________ÀÈ
È´2Èˋ£¿åÙ¿»°äøÅ¥ÆàŠFeS2ñÜå—ǵàÉؤøÅFe2+çᤘê¢È˜ë˜òÝÆÅH2SO4躰èȘëõ°è¡ûñÇÆÎçáâŠæÆñ§°äò§È¤_________FeS2+14Fe3++______H2O´T15Fe2++______SO42-+______ÈÛ
È´3Èˋôùå■Açáø¼Øˆ°èñøöˆ_________ÀÈ
È´4Èˋèºýº¿»°äøÅȘöˆêùàñÝÈ交šçáÇ¢ÑàȘ₤¿»°äÅÒ؈缧ÖàÉؤçápHçáñÑöÏòú___________;(ý¢ñøî¶âŠæÆØåúãî¾£₤öÿÅöò§°êçÚòÝàÉؤçápH¥«üôÝÚ)
°êçÚöÿ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
¢ˆò¥°êçÚ | 2.7 | 3.8 | 7.5 | 9.4 |
ëõਰêçÚ | 3.2 | 5.2 | 9.7 | 12.4 |
öˆçûç§Ç¢ƒ£çáFe(OH)3¿ääÍȘÅÒ؈Ñå°êçÚ§½ÅÅüÇçÆȘéÅÑü°êçÚFe(OH)3òúñþüǃ£çáñ§ñ´òú____________________ÀÈ
È´5ÈˋçÝâŠæÆé´ÑàÀÉ1Àê10-5mol/LòÝ¢èàüöˆóð°êçÚëõà¨ÀÈà¶Øˆò¿Mg2+ëõਰêçÚå·ØˆÝÈ°øc(OH-)Àï_____________ÀÈÈ´ØîøˆKsp[Mg(OH)2]=5.6Àê10-12Ș![]() Èˋ
Èˋ


