题目内容
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式_____________
(2)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态:①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是_________(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是____。
②O3分子的中心原子杂化类型为______;与O3互为等电子体的是______(任意写一种)。
(4)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(5)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg·cm3。
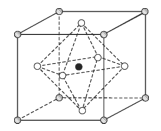
①Na3OCl晶胞中,O位于各顶点位置,Cl位于______位置。
②用a、d表示阿伏加德罗常数的值NA=_____(列计算式)。
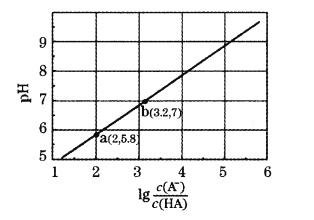
【答案】3d24s14p1 A H2O2分子间存在氢键 sp2 SO2 BE 体心 ![]()
【解析】
(1)Ti为22号元素,其基态原子的核外电子排布为1s22s22p63s23p63d24s2,一个4s轨道上的电子激发到4p轨道上,则该激发态的电子排布为1s22s22p63s23p63d24s14p1,价层电子排布式为3d24s14p1;
(2)基态的锌、铜原子的核外电子排布式分别为[Ar]3d104s2、[Ar]3d104s1。则①为基态Zn原子,②为Zn+,③为基态铜原子,④为Cu+。同一周期从左到右原子的第一电离能有增大的趋势,因此第一电离能①>③;原子的第二电离能大于第一电离能,由于Cu+的价层电子结构为3d10,3d为稳定的全充满结构,使得电离能增大,因此电离能④>②,综合电离能排序为④>②>①>③;A符合题意;
(3)①Cl2O2和H2O2均为分子,其沸点取决于分子间作用力,虽然Cl2O2的相对分子质量比H2O2大,但是H2O2间能够形成氢键,使得H2O2的沸点高于Cl2O2;
②根据价层电子对互斥理论,O3分子中中心O原子的价层电子对为![]() ,则其杂化类型为sp2;等电子体是指原子总数相同,价电子数相等的微粒,与O3互为等电子体的是SO2;
,则其杂化类型为sp2;等电子体是指原子总数相同,价电子数相等的微粒,与O3互为等电子体的是SO2;
(4)反应中,形成的化学键有Na3OCl中的Na+和O2-、Na+和Cl-间的离子键,以及H2中H原子和H原子的非极性键;BE符合题意;
(5)①Na3OCl晶体结构中,空心白球位于面心,为2个晶胞所共有,则一个晶胞中空心白球有![]() 个,实心黑球位于晶胞内部,为此晶胞所有,则一个晶胞中实心黑含有1个,O位于顶点,为8个晶胞所共有,则一个晶胞中O含有
个,实心黑球位于晶胞内部,为此晶胞所有,则一个晶胞中实心黑含有1个,O位于顶点,为8个晶胞所共有,则一个晶胞中O含有![]() 个,根据Na3OCl的化学式,可判断Cl位于体心;
个,根据Na3OCl的化学式,可判断Cl位于体心;
②晶胞参数为anm,密度为dg·cm3。根据密度公式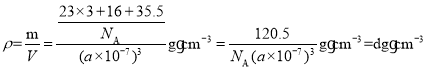 ,可得
,可得![]() 。
。

【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为放热反应
B.达平衡时,容器Ⅱ中CH3OCH3的浓度大于0.16 mol/L
C.达平衡时,容器Ⅲ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
D.若起始时向容器Ⅰ中充入CH3OH(g)0.30 mol、CH3OCH3(g)1.50 mol和H2O(g)0.30 mol,则反应将向逆反应方向进行
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
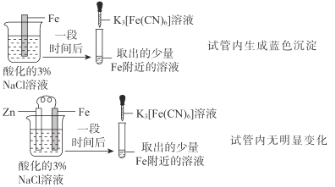
A |
| Zn保护了Fe不被腐蚀 |
B |
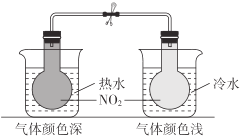
| 2NO2(g)N2O4(g)为吸热反应 |
C |
| 木炭与浓硝酸发生了反应 |
D |
| 碳酸钠的水解程度强 |
A.AB.BC.CD.D