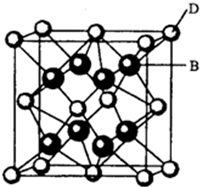
题目内容
5.Co(Ⅲ)的八面体配合物CoClm•nNH3,若1mol 配合物与足量AgNO3溶液作用生成1mol AgCl沉淀,则m、n的值是( )| A. | m=1,n=5 | B. | m=3,n=4 | C. | m=5,n=1 | D. | m=3,n=3 |
分析 配合物中外界离子在水溶液里能发生电离,內界原子不能发生电离,根据1 mol配合物生成1 mol AgCl沉淀,求出配离子显+1价,即外界有一个Cl-,且Co(Ⅲ)Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4.
解答 解:配合物中外界离子在水溶液里能发生电离,內界原子不能发生电离,1mol配合物生成1 mol AgCl沉淀,知道1 mol配合物电离出1 mol Cl-,即配离子显+1价,又因为外界有一个Cl-,且Co显+3价,所以[CoClm-1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6-2=4,所以m=3,n=4,
故选B.
点评 本题主要考查了配合物的组成,电离时外界电离,内界不电离是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.与I2<Br2<Cl2<F2的变化规律(由弱到强或由低到高或由少到多)不符合的是( )
| A. | 与氢气反应的难易程度 | B. | 氢化物的熔沸点 | ||
| C. | 非金属性的强弱 | D. | 氢化物稳定性 |
16.已知酸性:H2SO4>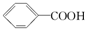 >H2CO3>
>H2CO3>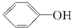 >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 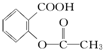 转变为
转变为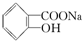 的最佳方法是( )
的最佳方法是( )
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将  转变为
转变为 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
20.部分弱酸的电离平衡常数如表,下列表述肯定正确的是( )
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A. | 相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 | |
| B. | ClO-+H2O+CO2→HClO+HCO3- | |
| C. | 2ClO-+SO2+H2O→2HClO+SO32- | |
| D. | 等体积、等物质的量浓度的HClO和Na2CO3混合后溶液呈中性 |
17.向次氯酸钙溶液中通入一定量SO2,可能出现的离子方程式为( )
| A. | Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ | |
| B. | Ca2++2ClO-+2SO2+2H2O→CaSO4↓+2Cl-+2H++SO42- | |
| C. | Ca2++3ClO-+3SO2+3H2O→CaSO4↓+3Cl-+6H++2SO42- | |
| D. | Ca2++3ClO-+SO2+H2O→CaSO4↓+2HClO+Cl- |
14.在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类.请选出各组的例外元素,并将该组其他元素的可能归属按所给6种类型的编号填入表内.
归属类型:①主族元素 ②过渡元素③同周期元素 ④同族元素⑤金属元素 ⑥非金属元素.
| 元素组 | 例外元素 | 其他元素所属类型的编号 |
| (1)S、N、Na、Mg | N | ③ |
| (2)P、Sb、Si、As | Si | ④ |
| (3)Rb、B、Br、Fe | Fe | ① |
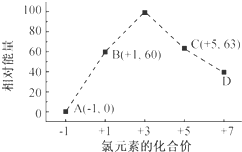 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.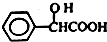 .工业上扁桃酸可以由烃A经过以下步骤合成得到:
.工业上扁桃酸可以由烃A经过以下步骤合成得到: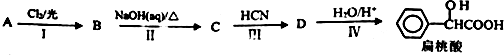
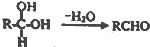
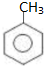 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
.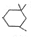 )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
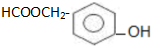 .
.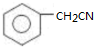 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸( )的合理路线.
)的合理路线.