题目内容
20.部分弱酸的电离平衡常数如表,下列表述肯定正确的是( )| 弱酸 | H2CO3 | H2SO3 | HClO |
| 电离平衡常数 (25℃) | K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A. | 相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3 | |
| B. | ClO-+H2O+CO2→HClO+HCO3- | |
| C. | 2ClO-+SO2+H2O→2HClO+SO32- | |
| D. | 等体积、等物质的量浓度的HClO和Na2CO3混合后溶液呈中性 |
分析 A.溶液的浓度未知,无法判断溶液pH大小;
B.酸性强弱:H2CO3>HClO>HCO3-,强酸能和弱酸盐反应;
C.次氯酸根离子和二氧化硫发生氧化还原反应;
D.二者反应生成NaClO和NaHCO3,混合溶液呈碱性.
解答 解:A.溶液的浓度未知,无法判断溶液pH大小,如果三者物质的量浓度相等,则pH关系:Na2CO3>NaClO>Na2SO3,故A错误;
B.酸性强弱:H2CO3>HClO>HCO3-,强酸能和弱酸盐反应,二者反应生成ClO-+H2O+CO2=HClO+HCO3-,故B正确;
C.次氯酸根离子和二氧化硫发生氧化还原反应,离子反应方程式为ClO-+SO2+H2O=Cl-+SO42-+2H+,故C错误;
D.二者反应生成NaClO和NaHCO3,碳酸氢根离子水解程度大于电离程度,次氯酸根离子水解,导致混合溶液呈碱性,故D错误;
故选B.
点评 本题考查了弱电解质的电离及盐类水解,明确电离平衡常数与酸性强弱、酸根离子水解程度之间的关系是解本题关键,再结合物质间的反应来分析解答,易错选项是C,注意二者能发生氧化还原反应,很多同学只根据酸性强弱进行解答而导致错误.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式CH3-CH=CH2 | ||
| C. | 羟基的电子式  | D. | 3-甲基-1-丁烯的键线式 |
11.Al(OH)3即能与酸起反应,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于( )
| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
8.国际无机化学命名委员会在1989年做出决定,把元素周期表原先的主、副族及族号取消,由左至右改为18列.如碱金属元素为第1列,稀有气体元素为第18列.按此规定,下列说法错误的是( )
| A. | 只有第2列元素的原子最外层有2个电子 | |
| B. | 第3列元素种类最多 | |
| C. | 第15列元素的最高价氧化物为R2O5 | |
| D. | 第17列元素的第一种元素无含氧酸 |
5.Co(Ⅲ)的八面体配合物CoClm•nNH3,若1mol 配合物与足量AgNO3溶液作用生成1mol AgCl沉淀,则m、n的值是( )
| A. | m=1,n=5 | B. | m=3,n=4 | C. | m=5,n=1 | D. | m=3,n=3 |
10. 一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )
 一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示.下列有关说法正确的是( )| A. | b电极为该电池的负极 | |
| B. | b电极附近溶液的pH减小 | |
| C. | a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 中间室:Na+移向左室,Cl-移向右室 |
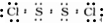 .
. .
.