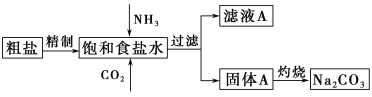
题目内容
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
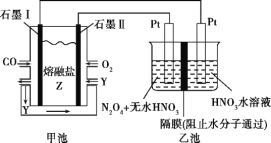
A. 石墨Ⅰ是原电池的负极,发生氧化反应
B. 甲池中的CO32-向石墨Ⅱ极移动
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3![]() 2N2O5+2H+
2N2O5+2H+
D. 若甲池消耗标准状况下的氧气2.24 L,则乙池中产生氢气0.05 mol
【答案】BD
【解析】
A、石墨Ⅰ电极上CO→CO2,碳元素化合价升高,发生氧化反应,石墨Ⅰ是原电池的负极,故A不选;
B、甲池是原电池,阴离子移向负极,故CO32-向石墨Ⅰ极移动,故选B;
C、乙池中左端Pt与原电池电源正极相连,为电解池阳极,电极反应式:N2O4-2e-+2HNO3=2N2O5+2H+,故C不选;
D、乙池的阴极反应为2H++2e-H2↑,若甲池消耗标准状况下的氧气2.24 L,转移电子0.4 mol,则乙池中产生氢气0.2 mol,故选D;
综上所述,本题应选BD。

 53随堂测系列答案
53随堂测系列答案【题目】60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表.
m-n | 0 | 1 | 2 | 3 |
含氧酸强度 | 弱酸 | 中强 | 强 | 很强 |
实例 | HClO | H3PO4 | HNO3 | HClO4 |
试回答下列问题:
(1)按此规则判断碳酸应属于_____酸。
(2)按此规则判断H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为_______________。
(3)H3PO3和H3AsO3的形式一样,但酸性强弱相差很大.已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构__________________、________________________。