题目内容
11.(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)请回答下列问题:
①该反应的生成物能量总和小于(填“大于”、“小于”或“等于”)反应物能量总和.
②若2mol氢气完全燃烧生成水蒸气,则放出的热量<(填“>”、“<”或“=”)572kJ.
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点来源丰富;热值高;燃烧后不产生污染.
(2)FeS2焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1═-197kJ•mol-1;
H2O(g)═H2O(l)△H2═-44kJ•mol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3═-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g))+H2O(g)=H2SO4(l)△H3=-152kJ/mol.
(3)已知下列反应的热化学方程式:
6C (s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2
C(s)+O2(g)═CO2(g)△H3
则反应4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为5△H2+12△H3-2△H1.
分析 (1)①反应物的能量低于生成物的能量,则反应吸热,反应物的能量高于生成物的能量,则反应放热;
②液态水变为水蒸气的过程是吸热的过程;
③氢气燃烧后不产生污染;
(2)利用盖斯定律,将热化学方程式进行运算,计算反应的焓变;
(3)根据盖斯定律,利用方程式的加减得出C3H5(ONO2)3分解成CO2、N2、H2O、O2的化学方程式,其反应热也要相应的加减,从而得出其热化学反应方程式.
解答 解:(1)①氢气燃烧生成液态水时放热,则反应物的能量高于生成物的能量,故答案为:小于;
②液态水变为水蒸气是吸热的过程,2mol氢气燃烧生成液态水时放出572kJ热量,生成气态水时放出的热量小于572kJ,故答案为:<;
③氢气燃烧时热值高,来源丰富,燃烧后不产生污染,故答案为:来源丰富;热值高;燃烧后不产生污染;
(2)2SO2(g)+O2(g)2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)×$\frac{1}{2}$ 得SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
故答案为:SO3(g) )+H2O(g)=H2SO4(l)△H3=-152kJ/mol.
(3)已知:
①6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
②2H2(g)+O2(g)═2H2O(g)△H2
③C(s)+O2(g)═CO2(g)△H3
由盖斯定律:5×②+12×③-2×①得:4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)△H=12△H3+5△H2-2△H1;
故答案为:5△H2+12△H3-2△H1.
点评 本题考查了反应热的计算,侧重于盖斯定律应用的考查,题目难度不大,准确把握盖斯定律的概念是关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 2I-+Cl2═I2+2Cl- | B. | 2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | ||
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | D. | 2Fe2++8I-+5Cl2═2Fe3++4I2+10Cl- |
| A. | 用10mL量筒量取8.10mL稀盐酸;用托盘天平称取25.0g氯化钠 | |
| B. | 用pH计测得某溶液的pH为2.3 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
| A. | 只含有碳、氢两种元素,不含氧元素 | |
| B. | 肯定含碳、氢两种元素,可能含氧元素 | |
| C. | 含碳、氢两种元素,且两者的质量比为11:9 | |
| D. | 含碳、氢、氧三种元素,且三者的质量比为8:1:16 |
| A. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ/mol | |
| B. | 稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 已知2C(s)+O2 (g)═2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol |
| A. | 氧化物 | B. | 盐 | C. | 碱 | D. | 酸 |
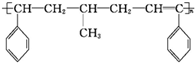 ,组成该化合物的单体可能为
,组成该化合物的单体可能为①

②CH2═CH2
③
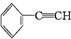
④CH2═CHCH3
⑤CH2═CH-CH═CH2
其中正确的组合是( )
| A. | ①②③ | B. | ①③④ | C. | ③④⑤ | D. | ②③⑤ |
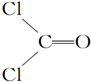 ,COCl2分子内含有( )
,COCl2分子内含有( )| A. | 4个σ键 | B. | 2个σ键、2个π键 | C. | 2个σ键、1个π键 | D. | 3个σ键、1个π键 |
