题目内容
2.下列有关实验操作的说法正确的是( )| A. | 用10mL量筒量取8.10mL稀盐酸;用托盘天平称取25.0g氯化钠 | |
| B. | 用pH计测得某溶液的pH为2.3 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
分析 A、量筒的最小读数为0.1mL,无法量取8.10mL的稀盐酸;
B、pH计测定较准确,读数可以读到0.1;
C、使用pH水中时,试纸不能湿润,否则可能影响测定结果;
D、碱式滴定管下端的橡胶管能被酸性高锰酸钾腐蚀.
解答 解:A、量筒是粗略量取液体体积的仪器,其读数只能读到0.1mL,无法用10mL量筒量取8.10mL稀盐酸,应该使用酸式滴定管,故A错误;
B、用pH计是一种较准确的测定溶液酸碱性的仪器,可以测得某溶液的pH为2.3,故B正确;
C、用pH试纸测定溶液的pH时,试纸不能湿润,否则会将待测液稀释,可能影响测定结果,故C错误;
D、碱式滴定管下端的橡胶管能被酸性高锰酸钾腐蚀,则应选25mL酸式滴定管量取20.00mL KMnO4溶液,故D错误;
故选B.
点评 本题考查化学实验方案的评价,涉及计量仪器的构造及其使用方法、试纸和pH计的使用方法,题目难度不大,注意掌握常见仪器的构造及使用方法,明确试纸在使用时不能用蒸馏水湿润.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
13.下列过程属于氮的固定的是( )
| A. | N2和H2在一定条件下合成氨 | B. | 由氨制成硫酸铵 | ||
| C. | NO和O2反应生成NO2 | D. | NO2与H2O反应 |
10.下列变化属于化学变化的是( )
| A. | 分馏 | B. | 干馏 | C. | 蒸馏 | D. | 萃取 |
17.碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性.其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 | |
| C. | 高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀 |
7.下列有关物质结构的表述正确的是( )
| A. | 次氯酸的电子式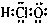 | B. | 乙烯的结构简式:C2H4 | ||
| C. | 二氧化碳的比例模型: | D. | Cl-的结构示意图: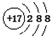 |
14.室温下,下列各组粒子能大量共存的是( )
| A. | K+、Al3+、SO42-、NH3•H2O | |
| B. | 在pH=12的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在pH=1的溶液中:K+、I-、Cl-、NO3- | |
| D. | 饱和氯水中:Cl-、NO3-、Na+、SO32 |
12.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
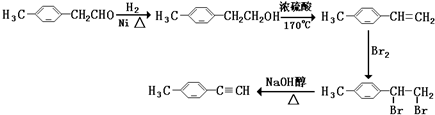
 烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4.与A相关的反应如下
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4.与A相关的反应如下 ;
;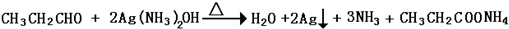 ;
; 、
、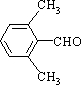 、
、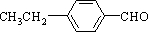 任意2种.(任写其中二种就可)
任意2种.(任写其中二种就可)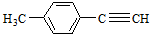 )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下: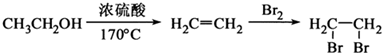
 .
.