题目内容
6.完全燃烧3.2g某有机物,生成8.8g 二氧化碳和7.2g 水,关于该有机物的说法正确的是( )| A. | 只含有碳、氢两种元素,不含氧元素 | |
| B. | 肯定含碳、氢两种元素,可能含氧元素 | |
| C. | 含碳、氢两种元素,且两者的质量比为11:9 | |
| D. | 含碳、氢、氧三种元素,且三者的质量比为8:1:16 |
分析 根据n=$\frac{m}{M}$计算出生成的二氧化碳和水的物质的量,再根据质量守恒确定该有机物分子中含有C、H的质量,从而确定是否含有氧元素;根据计算结果再计算出该有机物分子中含有各元素的质量之比.
解答 解:8.8g二氧化碳的物质的量为:$\frac{8.8g}{44g/mol}$=0.2mol,该有机物分子中含有C的质量为:12g/mol×0.2mol=2.4g,
7.2g水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,该有机物分子中含有H的物质的量为0.8mol,质量为:1g/mol×0.8mol=0.8g,
该有机物中含有C、H的总质量为:2.4g+0.8g=3.2g,
所以该有机物分子中不含有O元素,故A正确、BD错误;
该有机物分子中含有的碳、H元素的质量之比为:2.4g:0.8g=3:1,故C错误;
故选A.
点评 本题考查了有机物分子式确定的计算与判断,题目难度中等,根据质量守恒定律确定是否含有氧元素为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | 3,3-二甲基-1-丁烯在一定条件下与氢气充分反应后得到3,3-二甲基丁烷 | |
| B. | 工业生产中用乙醇与氢氧化钠作用生成乙醇钠,故乙醇可以与氢氧化钠溶液反应 | |
| C. | 地球上最基本的能源是太阳能,植物通过光合作用吸收太阳能,被吸收的太阳能通过各种形式的化学反应转化为化学能,物质中的化学能又可以通过各种形式的化学反应转化为热能、光能或电能 | |
| D. | 道尔顿、汤姆生、卢瑟福、波尔和门捷列夫等科学家对原子结构模型的建立均作出了卓越的贡献 |
17.碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性.其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | 氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 | |
| C. | 高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸沉淀 |
14.室温下,下列各组粒子能大量共存的是( )
| A. | K+、Al3+、SO42-、NH3•H2O | |
| B. | 在pH=12的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在pH=1的溶液中:K+、I-、Cl-、NO3- | |
| D. | 饱和氯水中:Cl-、NO3-、Na+、SO32 |
1.下列各组物质中属于同系物的是( )
| A. | 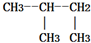 与 与 | B. | CH2=CH2与CH-CH3 | ||
| C. | 氢H和重氢D(${\;}_{1}^{1}$H与${\;}_{1}^{2}$H) | D. | 氧气与臭氧(O3) |
18.下列实验设计能够成功的是( )
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$滴加$\stackrel{硝酸钡溶液}{→}$白色沉淀滴加$\stackrel{稀盐酸}{→}$沉淀不溶解-→说明试样已变质 | |
| B. | 除去粗盐中硫酸钙杂质:粗盐$\stackrel{溶解}{→}$足量$\stackrel{碳酸钠溶液}{→}$足量$\stackrel{氯化钡}{→}$溶液$\stackrel{过滤}{→}$滤液中$\stackrel{滴加}{→}$盐酸$\stackrel{结晶}{→}$精盐 | |
| C. | 检验某溶液中是否含有Fe2+试样$\stackrel{KSCN溶液}{→}$溶液颜色无变化$\stackrel{滴加氨水}{→}$溶液变红色-→溶液中含有Fe2+ | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液30%$\stackrel{H_{2}O_{2}}{→}$稀硝酸$\stackrel{淀粉}{→}$溶液变蓝色-→氧化性:H2O2>I2 |
15.下列变化属于物理变化的是( )
| A. | 石油的裂化 | B. | 石油裂解 | C. | 石油的分馏 | D. | 古代植物变成煤 |
 回答下列问题:
回答下列问题: